微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 检验溶液中是否含有某种离子,下列操作方法正确的是?(?)
A.加入AgNO3溶液,有白色沉淀生成,证明含有Cl-
B.加入BaCl2溶液,产生白色沉淀,证明有SO42-
C.加浓NaOH溶液后加热,产生使润湿的红色石蕊试纸变蓝色的气体,证明有NH4+
D.无色溶液焰色反应呈黄色,证明试液一定不含K+
参考答案:C
本题解析:A 错误,加入AgNO3溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解,证明含有Cl-
B 错误,先加盐酸,再加BaCl2溶液,产生白色沉淀,证明有SO42-
C 正确,氨气是唯一一种能使润湿的红色石蕊试纸变蓝色的气体
D 错误,无色溶液焰色反应呈黄色,证明试液一定含有钠离子,不一定含有K+,要通过蓝色的钴玻璃观察,显紫色,才确定含有K+
本题难度:一般
2、选择题 选择合适的试剂(适量)对下列待提纯的物质进行除杂(括号内为杂质),
并写出相应的离子方程式。
待提纯的物质
| 选用的试剂
| 相应离子方程式
|
(1) Mg (Al)
| ?
| ?
|
(2) FeCl3(FeCl2)
| ?
| ?
|
?
参考答案:
?
选用的试剂(1分)
相应的离子方程式(2分)
(1)
NaOH溶液
2Al+2NaOH+2OH―=2AlO2―+3H2↑
(2)
新制的氯水或氯气
2Fe2+ +Cl2=2Fe3++2Cl―
本题解析:(1)镁和铝都是金属,都和酸反应,但铝和氢氧化钠溶液反应,镁和氢氧化钠溶液不反应,所以可以选取氢氧化钠溶液作除杂剂,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
答案为:NaOH溶液; 2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)氯气具有氧化性,将FeCl2氧化成FeCl3同时不引入新的杂质,新制的氯水或氯气,2Fe2+ +Cl2=2Fe3++2Cl―,答案:新制的氯水或氯气,2Fe2+ +Cl2=2Fe3++2Cl―。
本题难度:一般
3、选择题 NA表示阿伏加德罗常数值,以下说法正确的是
A.HCl气体的摩尔质量等于NA个Cl2分子和NA个H2的质量之和
B.常温常压下1 mol氯气含有2NA个Cl-
C.121 gCCl2F2所含氯原子数为2NA
D.62 gNa2O溶于水后溶液含有O2-数为NA
参考答案:C
本题解析:本题考查了阿伏加德罗常数、摩尔质量等概念,阿伏加德罗常数、摩尔质量、物质的量以及物质所含粒子数之间的关系;HCl气体摩尔质量在数值上等于1 mol,即NA个氯化氢分子的质量之和,而NA个Cl2和NA个H2分子质量之和等于2Na个HCl分子的质量之和,故A项不正确;氯气分子中不含Cl-,B项错;CCl2F2的摩尔质量为121 g·mol-1,Na2O与水生成OH-无O2-,所以C项正确,D项错误.
本题难度:困难
4、选择题 用NA表示阿伏加德罗常数的值.下列说法中,正确的是
A.1?mol?OH-中含有的电子数目为10?NA
B.标准状况下,22.4?L苯含有的原子数目为12?NA
C.1?L?0.1?mol/L?FeCl3溶液中,Fe3+的数目为0.1?NA
D.0.3?mol?NO2溶于水生成HNO3,转移的电子数目为0.3?NA
参考答案:A
本题解析:分析:A.1个OH-中含有10个电子,根据N=nNA计算电子数目;
B.标准状况下,苯是液体;
C.Fe3+在水中发生了水解;
D.3NO2+H2O=2HNO3+NO,1mol该反应转移2mol电子.
解答:A.1个OH-中含有10个电子,1molOH-中含有的电子数目为10NA,故A正确;
B.标准状况下,苯是液体,不能使用气体摩尔体积22.4L/mol,故B错误;
C.1 L 0.1 mol?L-1 FeCl3溶液含有0.1 mol FeCl3,其电离出来的0.1 NA个Fe3+中有一部分发生了水解,导致溶液中Fe3+数少于0.1NA,故C错误;
D.3NO2+H2O=2HNO3+NO,3个NO2中有2个变为HNO3,N由NO2中的+4变为HNO3中的+5,失去1个电子×2;1个NO2变为NO,N由NO2中的+4变为NO中的+2,得到2个电子.1mol该反应转移2mol电子,故0.3?mol?NO2溶于水生成HNO3,转移的电子数目为0.2NA,故D错误.
故选A.
点评:考查常用化学计量数的有关计算,难度不大,注意D项中转移的电子数.
本题难度:一般
5、选择题 t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g?cm-3)相同浓度的KCl溶液.现将甲烧杯中的溶液蒸发掉35.0gH2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g.下列说法正确的是
A.原溶液的质量分数为20%
B.t℃时,KCl的溶解度为50.0g
C.原溶液的物质的量浓度为3.0mol?L-1
D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
参考答案:B
本题解析:分析:甲乙两烧杯中的溶液由不饱和转变成饱和溶液溶剂相差10.0g,溶质相差5.0g,5.0g溶质溶解在10g溶剂中所形成的溶液为饱和溶液.由此可知该温度下的溶解度为50.0g.根据溶解度可求出原溶液的溶质为25.0g,所以原溶液的质量分数为25%,代入可知浓度为c=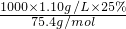 =3.7mol?L-1,两烧杯中剩余溶液均为饱和溶液,质量分数相等.
=3.7mol?L-1,两烧杯中剩余溶液均为饱和溶液,质量分数相等.
解答:A.设原100gKCl溶液中含溶质KCl的质量为xg,根据饱和溶液中的溶解度计算公式得下列关系式:
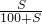 =
=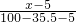 =
= ,解得x=25 g,所以原KCl溶液的质量分数为
,解得x=25 g,所以原KCl溶液的质量分数为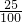 ×100%=25%,故A错误;
×100%=25%,故A错误;
B.据题意得,蒸发35.0g水析出KCl固体5.0g,蒸发45.0g水析出KCl固体10.0g,推断出蒸发10.0g水析出KCl固体5.0 g,故100g水中溶有50g KCl固体得到饱和溶液,即KCl的溶解度为50g,故B正确;
C.原溶液的质量分数为25%,代入可知浓度为c=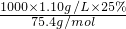 =3.7mol?L-1,故C错误;
=3.7mol?L-1,故C错误;
D.甲、乙烧杯中蒸发水后均有KCl固体析出,说明均已达到饱和,此时质量分数相伺,故D错误.
故选B.
点评:本题考查溶解度的有关问题,考查学生的思维能力,题目难度中等,注意根据根据溶液和溶质质量变化计算溶液的质量分数和溶解度为解答该题的关键.
本题难度:困难