微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列方法可以加快铁和稀硫酸反应速率的是
A.加入少量氯化锌
B.加入少量硫酸铜
C.降温
D.增大压强
参考答案:B
本题解析:略
本题难度:简单
2、实验题 (16分)(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当____ ,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
序号
| 滴定前读数(mL)
| 滴定后读数(mL)
|
1
| 0.00
| 20.10
|
2
| 1.00
| 20.90
|
3
| 0.00
| 22.10
|
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是__________。
A 未用标准浓度的酸性KMnO4溶液润洗滴定管
B 滴定前锥形瓶有少量水
C 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
参考答案:(1)①硫酸(1分), < (1分)
②5H2C2O4 + 2MnO4- + 6H+=10CO2↑ + 2Mn2+ + 8H2O (3分,不配平或配平错扣1分)
(2)②酸式 (2分);反应中生成的Mn2+具有催化作用,所以随后褪色会加快 (2分);滴入最后一滴KMnO4溶液,锥形瓶内的颜色恰好变成浅紫红色,且半分钟不变化。(2分)
③20.00mL(2分); 90.00% (2分)④ACD (2分) (漏写一个得1分)
本题解析:(1)①高锰酸钾具有强氧化性,要酸化高锰酸钾溶液需要选用无还原性的酸,一般选稀硫酸,温度越高反应速率越快,则褪色时间越短,所以褪色所需时间tA<tB;
②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水,发生的离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(2)②酸性溶液只能盛放在酸式滴定管中,所以酸性高锰酸钾溶液应该盛放在酸式滴定管中,高锰酸根离子被还原生成的锰离子有催化作用而导致反应速率加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到终点;
③第三次消耗体积与第一次和第二次相差较大,所以要舍去,则消耗KMnO4溶液的平均体积=(20.10?0.00+20.90?1.00)÷2mL=20.00mL,设样品的纯度为x,
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
450g 2mol
5.0x×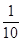 g (0.1×0.020)mol
g (0.1×0.020)mol
x= 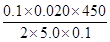 ×100%=90.00%;
×100%=90.00%;
A.酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大,故正确;B.锥形瓶内有水,对实验无影响,故错误;C.定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大,故正确;D.不小心将少量酸性KMnO4溶液滴在锥形瓶外,会导致测定高锰酸钾体积偏大,测定值偏大,故正确;E.观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小,故错误;故选ACD。
考点:考点探究物质的组成及其含量的测定的实验方案设计与评价
本题难度:困难
3、填空题 在2L密闭容器中发生3X(g)+Y(g)?

?Z?(g)+2W(g)反应,现在控制下列三种不同的条件:
①在400°C时,9mol?X?与3mol?Y?反应
②在400°C时,15mol?X?与5mol?Y?反应
③在300°C?时,9mol?X?与3mol?Y?反应
那么,(1)反应开始时,正反应速率最大的是(填序号,下同)______,正反应速率最小的是______;
(2)在①条件下的反应进行到第10min时,测得Z为1mol,此时v(Z)=______mol/(L?min);v(X)=______mol/(L?min).
参考答案:(1)因其他条件相同时,温度越高,化学反应速率越大,故①>③;其他条件相同时,反应物的浓度越大,化学反应速率越大,故②>①;故答案为:②;③;
(2)根据V(Z)=△C△t=△nV△t=1mol2L10min=0.05mol/(L?min),v(X)=3V(Z)=0.15mol/(L?min),
故答案为:0.05;0.15.
本题解析:
本题难度:一般
4、实验题 (7分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
实验室利用反应2H2O2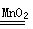 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号
| 条件
| 现象
| 结论
|
温度/℃
| 催化剂
|
1
| 40
| FeCl3溶液
| ?
| ?
|
2
| 20
| FeCl3溶液
| ?
| ?
|
3
| 20
| MnO2
| ?
| ?
|
4
| 20
| 无
| ?
| ?
|
实验1、2研究的是?对H2O2分解速率的影响。
实验2、3的目的是?
实验中可以表明该反应速率差异的现象是?
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是?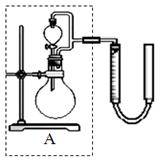
参考答案:(7分).①温度(1分)?比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异?产生气泡的快慢?②?旋转分液漏斗的活塞,控制滴加H2O2溶液的速率?(除注明外每空2分)
本题解析:①根据表中数据可知,实验1和2中不同的是温度,所以实验1、2研究的是温度对H2O2分解速率的影响;实验2、3中不同的是催化剂,所以其实验的目的是比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异。
②避免反应过于剧烈方法是控制加入双氧水的速率,所以正确的操作是旋转分液漏斗的活塞,控制滴加H2O2溶液的速率。
点评:在判断或验证外界条件对反应速率的影响时,需要注意的是,不能同时改变2个或多个条件,否则无法验证或判断。应该是在其它条件不变的情况下,逐步改变进行验证。同时还需要设计对比实验,以保证实验的科学性和准确性。
本题难度:简单
5、选择题 已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为1mol/(L?min),则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5?mol/(L?min)
B.1?mol/(L?min)
C.2?mol/(L?min)
D.3?mol/(L?min)
参考答案:对于反应A+3B=2C+D,以A的浓度变化表示的反应速率为1mol/(L?min),速率之比等于化学计量数之比,
所以1:2=1mol/(L?min):v(C),解得v(C)=2mol/(L?min),
故选C.
本题解析:
本题难度:简单