微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一密封体系中发生反应:N2 +3H2 2NH3 ΔH<0,
2NH3 ΔH<0,
①以下图1、图2均表示该反应在t1时达到平衡,在t2时改变某条件发生变化的曲线。
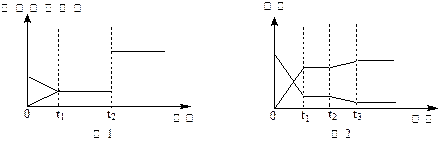
试判断,图1中t2时改变的条件是______________;图2中t2时改变的条件是____ _________。
②下图是某一时间段中反应速率与反应进程的曲线关系图:
下列各时间段时,氨的百分含量最高的是 。

A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
③工业生产中提高合成氨反应的反应速率和产率的具体措施是:
A.降低温度 B. 增大压强 C. 降低压强
D. 循环利用和不断补充氮气 E. 及时移出氨气
参考答案:①使用催化剂、降低温度 (2分/空)
②选A(2分)
③B、D、E(2分)
本题解析:略
本题难度:一般
2、选择题 向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小排列顺序正确的是
[? ]
甲 500 ℃,10 mol SO2和5 mol O2的反应
乙 500 ℃,用V2O5作催化剂,10 mol SO2和5 mol O2的反应
丙 450 ℃,8 mol SO2和5 mol O2的反应
丁 500 ℃,8 mol SO2和5 mol O2的反应
A.甲、乙、丙、丁
B.乙、甲、丙、丁
C.乙、甲、丁、丙
D.丁、丙、乙、甲
参考答案:C
本题解析:
本题难度:一般
3、选择题 在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g) 2G(g)。有关数据如下:
2G(g)。有关数据如下:
?
| E(g)
| F(g)
| G(g)
|
初始浓度(mol?L-1)
| 2.0
| 1.0
| 0
|
平衡浓度(mol?L-1)
| c1
| c2
| 0.4
|
下列判断正确的是
A.反应在前5min内,v(E)=0.04 mol/(L·min)
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0mol,则反应的△H>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol?L-1
参考答案:D
本题解析:A、反应在前5min内,根据题给数据图表分析,c1=1.6mol/L,c2=0.2mol/L,E的物质的量浓度变化为0.4 mol/L,反应速率v(E)=△c/△t=0.02mol/(L?min),错误;B、两种或两种以上物质反应,增大一种的浓度会提高另一种反应物的转化率,而本身转化率减小,其他条件不变,若增大E的浓度,则达平衡时E的转化率会减小,错误;C、降低温度,E物质的量减小,说明平衡正向进行,正反应为放热反应,△H<0,错误;D、起始量为E为4mol,F为2mol,平衡后移走2.0mol?E和1.0mol?F,相当于起始量减半,压强减小平衡逆向进行,G的浓度小于0.2mol/L,正确。
本题难度:一般
4、选择题 改变下列条件一定能加快反应速率的是( )
A.增大反应物的量
B.升高温度
C.增大压强
D.减小生成物的量
参考答案:A.增加反应物的物质的量,反应物的浓度不一定变化,如固体、纯液体,反应速率不一定加快,故A错误;
B.升高温度,增加单位体积内的活化分子数,有效碰撞增加,反应速率加快,故B正确;
C.增大压强对有气体参加的反应,反应速率加快,若没有气体参加,压强对反应速率不影响,故C错误;
D.减小生成物的量,若生成物为纯固体或液体,则浓度可能不变,可能减小,反应速率不会加快,故D错误;
故选B.
本题解析:
本题难度:简单
5、简答题 某同学对第四周期过渡元素产生浓厚的兴趣.想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:______.
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
实验
编号 | KClO3
(g) | 氧化物 | 产生气体(mL)
(已折算为标况) | 耗时(s)
化学式
质量(g)
回收
1
0.6
-
-
-
10
480
2
0.6
MnO2
0.20
90%
67.2
36.5
3
0.6
CuO
0.20
90%
67.2
79.5
4
0.6
Fe2O3
0.20
90%
67.2
34.7
5
0.6
Cr2O3
0.20
异常
67.2
188.3
|
V.实验讨论:
(1)请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数).
(2)在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7).该刺激性气体可能是______(填化学式),用______检验.(填序号)
A、湿润的蓝色石蕊试纸?B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸?D、湿润的红色石蕊试纸
Ⅵ.实验结论:______.
参考答案:I.本实验的目的是探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用,所以其课题名称为探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解反应的催化作用.
故答案为:探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解反应的催化作用;
V.(1)生成氧气的物质的量为n=VVm=0.0672L22.4L/mol=0.003mol,
2KCl3?CuO?.△2KCl+3O2↑
2mol?3mol?
0.002mol? 0.003mol
所以反应的氯酸钾的物质的量为?0.002mol,质量为m=nM=0.002mol×122.5g/mol=0.245g,
所以其分解率为0.245g0.6g×100%=40.8%,
故答案为:40.8%;
(2)根据元素守恒知,生成的刺激性气味的气体只能是氯气,氯气有氧化性,能置换出碘化钾中的碘,碘遇淀粉变蓝色,所以可用湿润的淀粉碘化钾试纸检验氯气,故选B.
故答案为:Cl2;B;
Ⅵ.?根据图表中回收的氧化物及耗时分析,CuO、Cr2O3?与二氧化锰比较,耗时较长且Cr2O3?的回收物有异常,氯化铁和二氧化锰的催化能力相近.
故答案为:氯化铁和二氧化锰的催化能力较好.
本题解析:
本题难度:一般