微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中,既含离子键又含共价键的是( )
A.NaCl
B.CO2
C.NaOH
D.N2
参考答案:C
本题解析:
本题难度:一般
2、简答题 按要求填空:
(1)羟基的电子式是______;
(2)相对分子质量为72且沸点最低的烷烃的结构简式:______;
(3)用系统命名法给有机物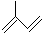 命名为______;
命名为______;
(4)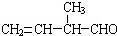 所含官能团的名称是______,该有机物发生加聚反应后,所得产物的结构简式为:______.
所含官能团的名称是______,该有机物发生加聚反应后,所得产物的结构简式为:______.
参考答案:(1)羟基中氧原子周围有7个电子,碳氧原子间共用一个电子对,所以羟基的电子式是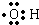 ,故答案为:
,故答案为: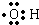 ;
;
(2)设该烷烃中碳原子个数是n,通式为CnH2n+2,14n+2=72,n=5,所以该烷烃是戊烷,烷烃的同分异构体中,支链越多,其沸点越低,所以相对分子质量为72且沸点最低的烷烃的结构简式C(CH3)4,故答案为:C(CH3)4;
(3)根据系统命名法命名,该有机物的名称是2-甲基-1,3-丁二烯,故答案为:2-甲基-1,3-丁二烯;
(4)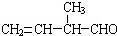 的官能团名称是碳碳双键、醛基,该有机物发生加聚反应后,所得产物的结构简式为
的官能团名称是碳碳双键、醛基,该有机物发生加聚反应后,所得产物的结构简式为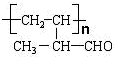 ,
,
故答案为: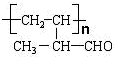 .
.
本题解析:
本题难度:一般
3、选择题 下列关于中学化学中的“水”对应正确的是( )
A.蒸馏水--H2O
B.氯水--Cl2、H2O、HClO、H+、Cl-、ClO-、OH-(少量)
C.王水--浓盐酸与浓硝酸的物质的量之比为1:3
D.硬水--含Mg2+、Ca2+的水,软水--不含Mg2+、Ca2+的水
参考答案:A.蒸馏水对应H2O,关系正确,故A正确;
B.氯水为混合物,水为溶剂及氯气与水的反应物,水不能对应其它微粒,故B错误;
C.王水指浓盐酸与浓硝酸的物质的量之比为3:1,故C错误;
D.硬水指含Mg2+、Ca2+较多的水,软水指含Mg2+、Ca2+较少的水,故D错误;
故选A.
本题解析:
本题难度:简单
4、填空题 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为________,B原子的杂化类型为________。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。图(a)是磷化硼晶体的晶胞示意图,则磷化硼的化学式为________,该晶体的晶体类型是________。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图(b)]。
①硼酸分子中B最外层有________个电子,1 mol H3BO3的晶体中有________mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为________元酸,[B(OH)4]-含有的化学键类型为________。

参考答案:(1)平面三角形 sp2
(2)BP 原子晶体
(3)①6 3 ②一 共价键、配位键
本题解析:(1)BF3分子中,B原子形成了3个σ键,不含孤电子对,故杂化轨道数为3,杂化方式为sp2杂化,BF3分子立体构型为平面三角形。(2)一个晶胞中含有B原子的个数为8×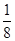 +6×
+6×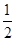 =4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H3BO3的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH)3·H2O可电离出1 mol H+,故硼酸为一元酸;[B(OH)4]-离子中B原子有一个空的2p轨道,而OH-含有孤电子对,两者之间可以形成配位键。
=4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H3BO3的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH)3·H2O可电离出1 mol H+,故硼酸为一元酸;[B(OH)4]-离子中B原子有一个空的2p轨道,而OH-含有孤电子对,两者之间可以形成配位键。
本题难度:一般
5、填空题 下表是元素周期表的一部分,其中A—G分别代表一种元素。?
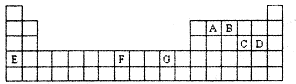
请根据表中所列元素,回答下列问题:
(1)所列元素中第一电离能最小的是?(填元素符号);D元素原子核外有?种不同运动状态的电子;基态原子的价电子层中,未成对电子数最多的元素是?(填元素符号)。?
(2)AC2分子的空间构型是?,该分子中A原子的杂化方式为?。
(3)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物的溶解度,原因是?。
(4)基态G2+的核外电子排布式是?,乙二胺(结构简式为H2N—CH2一CH2—NH2)分子中的碳原子的杂化方式为?,G2+与乙二胺可形成配离子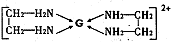 该配离子中含有的化学键类型有?(填字母编号)。
该配离子中含有的化学键类型有?(填字母编号)。
a.配位键? b.极性键? c.离子键? d.非极性键
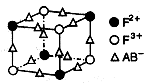
(5)化合物EF[F(AB)6]是一种常见的蓝笆晶体,其中的AB—与B2为等电子体,则、AB—的电子式为?。下图为该蓝色晶体晶胞的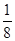 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为?个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为?个。
参考答案:(1)K? 17? Fe
(2)直线型? SP
(3)NH3与H2O分子之间存在氢键,CH4、H2S和H2O分子间不存在氢键
(4)1s22s22p63s23p63d9? SP3? abd
(5)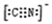 ? 4
? 4
本题解析:
(1)根据题意,A是C,B是N,C是S,D是Cl,E是K,F是Fe,G是Cu。第一电离能最大的是K。D是17号元素氯,有17种不同运动状态的电子。Fe的未成对电子数为4。
(2)CS2的与CO2的结构相同,所以也是直线型,SP杂化类型。
(3)NH3与H2O分子之间存在氢键,CH4、H2S和H2O分子间不存在氢键
(4)Cu2+的核外电子排布式是1s22s22p63s23p63d9,乙二胺中的碳原子形成的是单键,所以其杂化方式为 SP3。配离子中的化学键有非极性键、极性键、Cu2+与N之间是配位键。
(5)据“AB—与B2为等电子体”,则CN-的电子数也为14。据图知,F2+为 X4,F3+为
X4,F3+为 X4,AB-为
X4,AB-为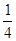 X12=3,根据电荷数整体为0的原则,该蓝色晶体晶胞的
X12=3,根据电荷数整体为0的原则,该蓝色晶体晶胞的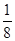 (E+未画出),
(E+未画出),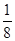 个中的E+为
个中的E+为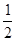 。则该蓝色晶体的一个晶胞中E+的个数为8x1/2="4"
。则该蓝色晶体的一个晶胞中E+的个数为8x1/2="4"
本题难度:困难