微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分子含有的电子数目与HF相同,且只有两个极性共价键的是
[? ]
A.CO2
B.H2O
C.NH3
D.CH4
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列各组数据中比值不为1:2的是
A.乙烷中C-C的键能与乙烯中C=C的键能之比
B.金刚石晶体中碳原子个数与C-C共价键个数之比
C.Al基态原子核外最外层P轨道和S轨道电子数之比
D.碳基态原子核外未成对电子数和成对电子数之比
参考答案:A
本题解析:
答案:A
A不正确,双键中有一个δ,一个∏键,键能不是单键能的二倍。
本题难度:一般
3、选择题 观察下列模型并结合有关信息,判断有关说法正确的是( )
| B12结构单元 | SF6分子 | S8 | HCN
结构模型示意图




备注
熔点1873K
/
易溶于CS2
/
|
A.单质硼属原子晶体.结构单元中含有30个B-B键.含20个正三角形
B.SF6是由极性键构成的极性分子
C.固态硫S属于原子晶体
D.HCN的结构式为H:C::N
参考答案:A.由图知,每个B原子具有12×5个共价键,12个B原子共含有12×12×5=30个共价键,含有的三角形数目=30÷(12×3)=20,故A正确;
B.SF6空间构型为对称结构分子极性抵消,正负电荷的重心重合,电荷分布均匀,SF6为非极性分子,故B错误;
C.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故C错误;
D.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,碳原子半径大于氮原子半径,氮原子半径大于氢原子半径,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H-C≡N,故D错误.
故选A.
本题解析:
本题难度:简单
4、填空题 下表为长式周期表的一部分,其中的序号代表对应的元素。
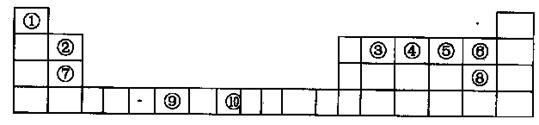
(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为?杂化,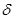 键与
键与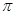 ?键的个数比为?。
?键的个数比为?。
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为?。其中⑥元素核外电子的电子排布图为?。
(3)③元素形成的最高价氧化物所形成的晶胞边长为acm,则其晶胞密度为?;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为?。
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型?,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为?,形成的化学键为?。
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序)?。
参考答案:(1)sp2;(1分) 5:1(1分)
(2)F>N>O>C?(1分)?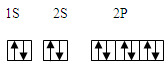 ?(2分)
?(2分)
(3)176/a3NA?g/cm3(2分)
(4)4Mg+10H++NO3-=4Mg2++NH4++3H2O ?(3分)
(5)分子晶体;(1分)配位键;(1分)金属键(1分)
(6)HNO3>HNO2或者HClO4>HClO3>HClO2>HClO(写出部分也给分)(2分)
本题解析:图表为元素周期表中前四周期元素,按照1——10顺序分别是H、Be、C、N、O、F、Mg、Cl、Cr、Fe(1)③与①形成乙烯,其中碳元素形成碳碳双键,sp2杂化;(2)第一电离能F最强,由于N原子p轨道上半充满,比较稳定,比O强,C原子最小,F>N>O>C?;(3)CO2晶胞是面心立方晶体,其中有4个分子,密度为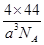 ;(4)镁与硝酸发生氧化还原反应,无气体生成,说明硝酸被还原为铵盐,得4Mg+10H++NO3-=4Mg2++NH4++3H2O;(5)A(BC)5是Fe(CO)5, 该配合物常温下为液态,熔点低,易溶于非极性溶剂,是分子晶体。
;(4)镁与硝酸发生氧化还原反应,无气体生成,说明硝酸被还原为铵盐,得4Mg+10H++NO3-=4Mg2++NH4++3H2O;(5)A(BC)5是Fe(CO)5, 该配合物常温下为液态,熔点低,易溶于非极性溶剂,是分子晶体。
本题难度:困难
5、选择题 下列化合中,只含有共价键的是( ? )
A.H2O
B.CaO
C.NaCl
D.NaOH
参考答案:A
本题解析:
本题难度:简单