|
高考化学知识点归纳《盐类水解的原理》试题预测(2017年最新版)(八)
2017-07-31 23:41:50
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.1 mol/L的CH3COONa溶液和0.1 mol/L的盐酸等体积混合后,溶液中离子浓度关系符合实际的是
A.c(CH3COO-)>c(CH3COOH)
B.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)
C.c(CH3COO-)+c(H+)>c(Cl-)
D.c(CH3COO-)+c(CH3COOH)=c(Na+)
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列溶液加热蒸干、灼烧后,能析出原溶质固体的是( )
A.AlCl3
B.KHCO3
C.Fe2(SO4)3
D.NH4HCO3
|
参考答案:C
本题解析:溶液加热蒸干、灼烧后所得固体成分的判断要考虑①水解型②分解型③氧化型。A、加热时促进Al3+水解,盐酸易挥发,生成Al(OH)3,灼烧的氧化铝固体,错误;B、KHCO3不稳定,加热易分解,所得固体成分为K2CO3,错误;C、加热时虽然促进Fe3+水解,但硫酸难挥发,硫酸和氢氧化铁反应生成Fe2(SO4)3,最后固体仍为Fe2(SO4)3,正确;D、NH4HCO3不稳定,加热易分解生成氨气、水和二氧化碳,无固体剩余,错误。
考点:考查盐类水解知识。
本题难度:一般
3、填空题 (1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
参考答案:(1)① < ② > ③ > ;
(2)NaOH 和 AlCl3
本题解析:(1)①因为CH3COOH为弱酸,稀释时电离平衡向右移动,所以pH= a的CH3COOH溶液稀释100倍后所得溶液pH<a +2。
②醋酸不完全电离,所以0.01mol/LCH3COOH溶液的pH>2。
③CH3COONa为弱酸强碱盐,水解显碱性,所以0.1mol/LCH3COONa溶液的pH>7。
(2)溶于水得到无色澄清溶液,说明不含Fe2(SO4)3,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生,说明原固体中含有NaOH和AlCl3。
考点:本题考查溶液酸碱性的判断、物质的推断。
本题难度:困难
4、填空题 (12分)钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
参考答案:(1)K2SiF6+3H2O=2KF+H2SiO3↓+4HF;(2分);HF+OH-=H2O+F-;(2分)
(2)偏高;(3) 30%。
本题解析:(1)上述步骤产生的氟硅酸钾(K2SiF6)沉淀在热水中水解,生成HF、H2SiO3、KF。②中的水解反应方程式为K2SiF6+3H2O=2KF+H2SiO3↓+4HF;将步骤②中反应产生的硅酸沉淀过滤除去,用氢氧化钠标准溶液滴定滤液,由于HF是弱酸,所以在写离子方程式时应该用化学式,则步骤③中反应的离子方程式为HF+OH-=H2O+F-;(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则消耗标准溶液的体积就偏大,所以使得测得的硅元素含量将偏高;(3)根据实验数据可知第一次数据误差太大,要舍去,则消耗NaOH溶液的体积是:V(NaOH)=(19.90mL+20.00mL+20.10mL)÷3=20.00ml;根据方程式中物质的关系可得关系式:
SiO2——Si——4HF——4NaOH;
60g 4mol
M(SiO2) 0.02Lх1mol/L
求得m(SiO2)=0.30g(2分);硅的质量分数(以二氧化硅计):(0.30g÷1.00g)×100%=30%。
考点:考查物质制取过程的化学方程式、离子方程式的书写、误差分析、物质含量的测定的知识。
本题难度:一般
5、填空题 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。

(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。

① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
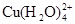 (aq) +4Cl-(aq) (aq) +4Cl-(aq)  (aq) +4H2O(l) (aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是 。
参考答案:(1)①分液漏斗
②MnO2+4H++3Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O
③分液漏斗的上口瓶塞没有打开
④NaOH溶液 吸收未反应的氯气,防止污染
(2)①K=c( )/c( )/c(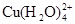 )c4(Cl-) )c4(Cl-)
② a 加水稀释 b AgNO3溶液
(3)抑制铜离子的水解,提高产品的产率。
本题解析:(1)氯气有毒,必须进行尾气处理
(2)变为蓝色则平衡向逆方向移动,可以加水,增加生成的浓度,也可以加入AgNO3溶液减少Cl-浓度。
(3)Cu2+易发生水解,加热促进水解,同时HCl易挥发,也促进水解,所以直接加热得不到氯化铜晶体。
本题难度:困难
|