| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《盐类水解的原理》试题预测(2017年最新版)(六)
参考答案:AD 本题解析: 本题难度:一般 2、选择题 为了除去MgCl2酸性溶性中的Fe3+可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸,这种试剂是 |
参考答案:D
本题解析:Fe3+易水解生成沉淀,可通过调节溶液pH的方法促进Fe3+的水解,达到除杂的目的,A.加入氨水混入氯化铵杂质,且生成氢氧化镁沉淀,错误;B.加入NaOH易生成氢氧化镁沉淀,且混入NaCl杂质,错误;C.加入碳酸钠,易混入NaCl杂质,错误;D.加入碳酸镁,与氢离子反应,可起到调节溶液pH的作用,促进铁离子的水解生成氢氧化铁沉淀而除去,且不引入新的杂质,正确,选D。
考点:考查盐类水解的应用。
本题难度:一般
3、选择题 下列说法不正确的是
A.0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-)
B.在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+) ="c(OH" -)+2c(CO32-)+c(HCO3-)
C.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡
D.常温常压下能自发进行的反应,一定都是放热反应
参考答案:D
本题解析:硫酸铵化学式为(NH4)2SO4,属于强酸弱碱盐,水溶液呈酸性,所以A正确;根据电荷守恒原理可知,溶液中阴离子带的负电荷总数应该等于阳离子带的正电荷,故B正确;Na2CO3属于强碱弱酸盐,水溶液呈碱性,所以滴有酚酞的溶液变红,当加入氯化钡溶液后,生成碳酸钡沉淀和氯化钠溶液,呈中性,故C正确;能否自发进行,除了和焓变有关,与熵变也有关,它们共同决定,故D错误。
考点:考查电离平衡相关知识
本题难度:一般
4、选择题 0.1?mol·L-1的下列物质的水溶液中,氢离子浓度最大的是
A.NH3·H2O
B.NH4Cl
C.HCl
D.HCOOH
参考答案:C
本题解析:盐酸是强酸,盐所以盐酸溶液中氢离子的浓度最大,酸性最强。答案选C。
本题难度:一般
5、填空题 (共8分)在常温下,下列六种溶液:
①0.1mol/L ②0.1mol/L
②0.1mol/L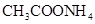 ③0.1mol/L
③0.1mol/L
④0.1mol/L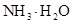 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L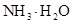 ⑥0.1mol/LNH4HCO3
⑥0.1mol/LNH4HCO3
请根据要求填写下列空白:
(1)溶液①呈 性,其原因是 (用离子方程式表示)
(2)在上述六种溶液中,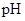 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>” “<”或“=”)
的大小关系是② ③(填“>” “<”或“=”)
(4)常温下,测得溶液②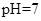 ,说明
,说明 水解程度
水解程度 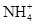 水解程度。(填“>”、“<”或“=”)
水解程度。(填“>”、“<”或“=”)
(5)请写出③的电离方程式: 。
(6)请写出0.1mol/L的NH4HCO3物料守恒关系式:
参考答案:(共8分) (1)酸 NH4++H2O?NH3?H2O+H+(2)3 ; 5 (填序号)
(3)< (填“>” “<”或“=”) (4) =
(5)NH4HSO4=NH4+ + H+ + SO42- (6)[H+]+[H2CO3] =[NH3?H2O]+[OH-]+[CO32-]
本题解析:(1)氯化铵是强酸弱碱盐,铵根离子水解显酸性;水解离子方程式为:NH4++H2O?NH3?H2O+H+;
答案为:酸 NH4++H2O?NH3?H2O+H+;(2)假设铵根离子不考虑水解,①0.1mol/L NH4Cl中铵根离子浓度0.1mol/L;②0.1mol/L CH3COONH4醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性;④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;⑤0.1mol/L NH3?H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;⑥0.1mol/LNH4HCO3中,碳酸氢根离子水解促进铵根离子水,铵根离子浓度小于0.1mol/L;所以溶液PH最小的是③,铵根离子浓度最小的是⑤;答案为:③;⑤;(3)②0.1mol/L CH3COONH4醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性溶液②、③中c(NH4+)的大小关系是小于,答案为:<;(4)常温下,测得溶液②的pH=7,说明0.1mol/L CH3COONH4溶液中醋酸根离子和铵根离子水解程度相同,答案为=;(5) ③的电离方程式: NH4HSO4=NH4+ + H+ + SO42-
(6) NH4HCO3物料守恒关系式:[H+]+[H2CO3] =[NH3?H2O]+[OH-]+[CO32-]
考点:考查盐类水解的应用,离子浓度大小的比较。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的量浓.. | |