微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在指定条件下,下列各组离子可能大量共存的是
[? ]
A.某透明的酸性溶液中:Cl-、Na+、MnO4-、SO42-
B.水电离产生的c(H+)为10 -12 mol.L-1的溶液中:K+、CO32-、Cl-、NO3-
C.在加入铝能产生氢气的溶液中:Na+、NH4+、I-、NO3-
D.能使pH试纸变红色的溶液中:Na+、AlO2-、K+、CO32-
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列有关溶液的叙述错误的是
A.常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1
B.常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol·L-1,则该溶液可能为NaOH溶液
C.相同温度下,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比小于2∶1
D.导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多
参考答案:D
本题解析:A:常温下醋酸铵溶液呈中性,是由于CH3COO—与NH4+水解程度相当所至;既然呈中性,溶液中c(H+)和c(OH-)必然相等且均为为1.0×10-7。
B:常温下,水电离出来的c(OH-)=1.0×10-12 mol·L-1远小于1.0×10-7 mol·L-1,电离受抑制,完全可能是由于NaOH电离出的OH—引起。
C:假设醋酸为强酸,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比应等于2∶1,可是由于醋酸是弱酸,1 mol·L-1醋酸溶液稀释为0.5 mol·L-1醋酸溶液的过程中,促进及电离,致使酸性相对增强,导致c(H+)之比小于2∶1。
D:导电性与溶液中自由移动离子的浓度相关,本选项描述错误。
本题难度:一般
3、填空题 (10分)回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为 NaHSO4= Na+ + H+ + SO42-。在NaHSO4溶液中c(H+)??c(OH-)+ c(SO42-)(填 “>”、“=”或“<”)。
(2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈?(填“酸性”、“中性”或“碱性”),c点所示的离子方程式为?。
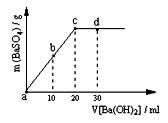
(3)在t℃时,将NaHSO4晶体加入到pHH= 6的蒸馏水中,保持温度不变,测得溶液的pHH为2。t℃将?25℃(填“高于”或“低于”),Kw=?,在该溶液中由水电离出的c(H+)为?mol / L。t℃时,将pH =11的NaOH溶液V1L与pH =1的H2SO4溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1∶V2 =?,此溶液中各种离子的浓度由大到小的排列顺序为?。
(4)在0.1mol / L的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c (NH4+)由大到小的排列顺序为?。(用序号填空)
参考答案:
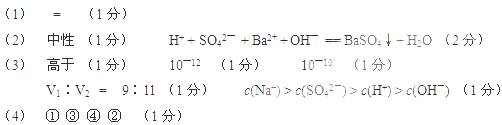
本题解析:略
本题难度:一般
4、选择题 在下列溶液中,一定能大量共存的一组离子是?(?)
A.溶液的pH=13:ClO-、HCO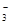 、Na+、Mg2+
、Na+、Mg2+
B.溶液中含有大量NO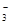 :NH4+、I-、SO
:NH4+、I-、SO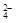 、H+
、H+
C.溶液中c(HCO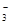 )=0.1 mol/L:Na+、K+、CO
)=0.1 mol/L:Na+、K+、CO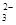 、Br-
、Br-
D.溶液中由水电离出的c(H+)=1×10-13 mol/L:Na+、HCO3-、Cl-、Br-
参考答案:C
本题解析:A、pH=13,则溶液呈碱性,HCO3-不能大量共存(因与OH-反应生成CO32-、H2O),Mg2+不能大量共存(因与OH-反应生成氢氧化镁沉淀);
B、H+、NO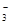 、I-不能大量共存(因发生氧化还原反应);
、I-不能大量共存(因发生氧化还原反应);
D、说明水的电离受到抑制,则溶液可酸性,可碱性:HCO3-在酸性(与H+反应生成CO2、H2O)、碱性(与OH-反应生成CO32-、H2O)条件下都不能大量共存;
本题难度:一般
5、选择题 室温下,下列各组离子在指定溶液中能大量共存的
A.pH=1的溶液中k+CrO42-SO42-NH4+
B.饱和氯水中Cl-NO3-Na+SO32-
C.能使pH试纸变红的溶液NH4+Na+SO42-Fe2+
D.FeCl2溶液中K+Na+SO42-AlO2-
参考答案:C
本题解析:A错,CrO42-?在酸性溶液中不能共存会生成铬酸,铬酸为弱酸;B错,SO32-在饱和氯水中能被氧化;C正确,能使pH试纸变红的溶液为酸性溶液,离子间可大量共存;D错,Fe2+与AlO2-会发生双水解反应;
本题难度:一般