微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)(1)从NaCl、CuSO4两种电解质中选取适当的物质,按电解要求填写(填化学式):
①以铜为电极,进行电解时电解质浓度不变,则采用的电解质是__________。
②以碳棒为电极,进行电解时使电解质和水的质量均变小,则采用的电解质是________。
此电解反应的阳极反应式: ,电解池的总反应化学方程式: 。
(2)①甲同学用直流电源、碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)===CuSO4+H2↑,则该同学选用的阳极材料是_______。
②乙同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀。请你选出最可能的原因 (填字母代号)
A.铜被稀硫酸钝化 B.碳棒和铜棒与电源正负极接反
此时的电解池的总反应为____________ ____________
参考答案:(15分)(1)①CuSO4 (2分)
②NaCl (2分) 2Cl--2e-=Cl2↑(2分)
2NaCl+2H2O 2NaOH+H2↑+Cl2↑(3分)
2NaOH+H2↑+Cl2↑(3分)
(2)①铜棒 (2分)
②B(2分) 2H2O 2H2↑+O2↑
2H2↑+O2↑
本题解析:(1)①以铜为电极,进行电解时,电极氯化钠溶液,阳极是Cu失去电子生成铜离子进入溶液,阴极是氢离子放电生成氢气,氯化钠的浓度增大;而电解硫酸铜溶液,阳极是Cu失去电子进入溶液,阴极是铜离子得到电子生成单质铜析出,所以硫酸铜的浓度基本不变,所以选择CuSO4;
②以碳棒为电极,进行电解时,电解氯化钠溶液,阴极是水电离产生的氢离子放电生成氢气,阳极是氯离子放电生成氯气,则溶液中的水和氯化钠的质量都减小;电解硫酸铜溶液,阴极是铜离子放电生成单质铜,阳极是氢氧根离子放电,产生氧气,所以溶液中的硫酸铜与水的质量都减少,二者均符合题意,答案是NaCl、CuSO4;阳极的反应式为2Cl--2e-=Cl2↑或2H2O-4e-= O2↑+4H+;总反应方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑或2 CuSO4+2H2O
2NaOH+H2↑+Cl2↑或2 CuSO4+2H2O 2 H2SO4+O2↑+2Cu;
2 H2SO4+O2↑+2Cu;
(2)①Cu+H2SO4(稀)===CuSO4+H2↑该反应一般不会实现,但在电解时用Cu作阳极,稀硫酸作电解质溶液,则该反应会发生;
②首先Cu与稀硫酸不会发生钝化,当电源的正负极接反时,Cu作阴极,则Cu不会参加反应,该反应实质是电解水,答案选B;电解水的化学方程式为2H2O 2H2↑+O2↑ 。
2H2↑+O2↑ 。
考点:考查电化学原理的应用,实验现象的分析与判断
本题难度:困难
2、选择题 根据金属活动性顺序表,Cu不能发生:Cu+2H2O==Cu(OH)2+H2↑的反应。但选择恰当的电极材料和电解 质溶液进行电解,这个反应就能实现。下列四组电极和电解液中,能实现该反应最为恰当的一组是
[? ]
阳极
阴极
电解液
A.
石墨棒
石墨棒?
CuSO4溶液?
B.
Cu
石墨棒
Na2SO4溶液
C.
Cu
Fe
H2SO4溶液
D.
Cu
Pt
CuSO4溶液
参考答案:B
本题解析:
本题难度:一般
3、填空题 工业上处理含Cr2O72-的酸性工业废水常用以下方法:
①往工业废水里加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;
③过滤回收沉淀,废水达到排放标准.
试回答:
(1)电解时的电极反应:阳极________________,阴极____________________
(2)Cr2O72-转变成Cr3+的离子反应方程式:_____________________
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?________________________________
(4)能否用Cu电极来代替Fe电极?________(填“能”或“不能”),简述理由_____________________
参考答案:(1)Fe-2e-===Fe2+;2H++2e-===H2↑
(2)6Fe2++Cr2O72-+14H+===6Fe3++2Cr3++7H2O
(3)在阴极反应及Cr2O72-与Fe2+反应的过程中,将消耗大量的H+,使溶液pH上升,促使
Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀
(4)不能;因为阳极产生的Cu2+不能使Cr2O72-还原到低价
本题解析:
本题难度:一般
4、填空题 【化学——选修2化学与技术】(15分)
(一)(6分)下列叙述正确的是( )
A.合成氨的“造气”阶段会产生废气
B.电镀的酸性废液用碱中和后就可以排放
C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗
D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染
(二)工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
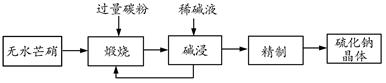
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式: 。
(2)用碱液浸出产品比用热水更好,理由是 。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。
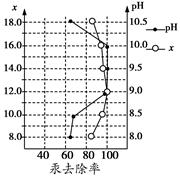
为使除汞达到最佳效果,应控制条件是 。
(4)取Na2S(含少量NaOH),加入到 CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)= mol·L-1。
[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在 ;该电极pH将 (填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因 。
参考答案:(一)AD(2分)(二)(1)3Na2SO4+8C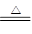 3Na2S+4CO2↑+4CO↑(2分)
3Na2S+4CO2↑+4CO↑(2分)
(2)热水能促进Na2S水解,而稀碱可抑制Na2S水解(2分)(3)pH介于9~10之间,x=12(2分)
(4)4.0×10-36 mol/L(3分) (5)阴极降低(2分) 2Cu2++2e-+H2O=Cu2O↓+2H+(2分)
本题解析:(一)A、合成氨反应的化学方程式为为N2+3H2 2NH3,因此所用的原料气是氮气、氢气。其中氮气来自于空气,氢气来自水和碳氢化合物的反应,用天燃气或煤制备氢气时会产生废气二氧化碳,A正确;B、酸性废液用碱中和后,溶液呈中性,但电镀液中仍然含有重金属离子,随意排放会污染水源和土壤,所以应处理后再排放,B错误;C、电解熔融氧化铝制金属铝时阳极上产生的是氧气,氧气具有氧化性,作为阳极材料的无烟煤会被氧气氧化成二氧化碳,煤会消耗,C错误;D、煤直接燃烧能够产生二氧化硫,从而形成酸雨。煤通过液化气化后,可以提高燃煤的燃烧效率,降低环境污染,D正确,答案选AD。
2NH3,因此所用的原料气是氮气、氢气。其中氮气来自于空气,氢气来自水和碳氢化合物的反应,用天燃气或煤制备氢气时会产生废气二氧化碳,A正确;B、酸性废液用碱中和后,溶液呈中性,但电镀液中仍然含有重金属离子,随意排放会污染水源和土壤,所以应处理后再排放,B错误;C、电解熔融氧化铝制金属铝时阳极上产生的是氧气,氧气具有氧化性,作为阳极材料的无烟煤会被氧气氧化成二氧化碳,煤会消耗,C错误;D、煤直接燃烧能够产生二氧化硫,从而形成酸雨。煤通过液化气化后,可以提高燃煤的燃烧效率,降低环境污染,D正确,答案选AD。
(二)(1)在高温下硫酸钠与碳反应生成等物质的量的CO和CO2,其中C元素化合价从0价升高到+4、+2价,硫酸钠中+6价S元素得到电子,被还原为-2价,化合价降低,则根据电子得失守恒和质量守恒定律可知配平后的化学方程式为3Na2SO4+8C 3Na2S+4CO2↑+4CO↑。
3Na2S+4CO2↑+4CO↑。
(2)硫化钠是强碱弱酸盐,在溶液中硫离子水解显碱性,水解吸热,用热水浸出产品会促进水解,而稀碱溶液能起到抑制水解的作用,所以用碱液浸出产品比用热水更好。
(3)根据图像可知pH介于9~10之间且x=12时汞的除去率最高。
(4)若反应后溶液pH=4,则溶液中氢氧根离子的浓度是10-10mol/L,所以根据氢氧化铜的溶度积常数可知,此时溶液中铜离子浓度是 =2.2mol/L,所以根据硫化铜的溶度积常数可知此时溶液中c(S2-)=
=2.2mol/L,所以根据硫化铜的溶度积常数可知此时溶液中c(S2-)=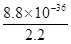 =4.0×10-36 mol/L。
=4.0×10-36 mol/L。
(5)铜离子转化为氧化亚铜,其中铜元素的化合价降低得到电子,因此电解生成Cu2O应在阴极生成;生成氧化亚铜的电解方程式为2Cu2++2e-+H2O=Cu2O↓+2H+,所以该电极溶液的酸性增强,pH降低。
考点:考查化学与技术模块的分析和判断
本题难度:困难
5、选择题 下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是

A.装置中的离子交换膜只能让阳离子通过,不能让阴离子通过
B.装置中出口①处的物质是氢气,出口②处的物质是氯气
C.除去杂质后的氢氧化钠溶液从出口B处导出
D.转移电子0.8 mol时产生氢气8.96 L(标准状态)
参考答案:B
本题解析:电解饱和食盐水时溶液阳极产生的气体是氯气,阴极产生的气体是氢气,所以①处的物质是氯气,出口②处的物质是氢气,B正确;离子交换膜可以让阴阳离子通过,A错误;阴极产生的氢气和氢氧化钠所以氢氧化钠溶液从B处导出,根据电极反应方程式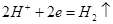 ,转移0.8moL电子时生成的氢气为0.4moL,体积为
,转移0.8moL电子时生成的氢气为0.4moL,体积为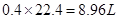 ,所以答案选B。
,所以答案选B。
本题难度:简单