微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+ 、?Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是?

[? ]
A.B膜是阴离子交换膜?
B.通电后,海水中阳离子往a电极处运动
C.通电后,a电极的电极反应式为? 4OH--4e-?=O2↑?+2H2O
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
参考答案:D
本题解析:
本题难度:一般
2、选择题 标况下,电解一定物质的量浓度的CuSO4溶液一段时间后,加入0.2molCu(OH)2固体使溶液完全恢复到初始状态,则此过程中共产生气体
A. 6.72L
B. 8.96L
C.11.2L
D.5.6L
参考答案:B
本题解析:加入0.2molCu(OH)2固体使溶液完全恢复到初始状态,说明在电解过程中,分两个阶段,即第一阶段是电解硫酸铜和水,第二阶段是电解水。根据原子守恒可知,生成的氧气和氢气分别都是0.2mol,所以标准状况下的体积是8.96L,答案选B。
本题难度:一般
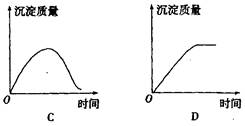
3、选择题 用石墨作电极电解3 mol·L-1 KCl和0.5 mol·L-1 Al2(SO4)3,的混合溶液时,下列电解变化的曲线合理的是? (? )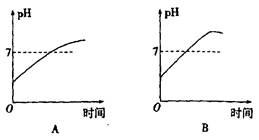
参考答案:D
本题解析:根据离子的放电顺序可知,阳极是氯离子失去电子,阴极是氢离子得到电子。当氯化钾恰好反应后,生成的OH-的浓度是3mol/L,而溶液中铝离子浓度是1.0mol/L,所以溶液中有氢氧化铝沉淀生成。但当氯化钾完全电解后,就相当于电解水,所以沉淀是不变的,所以选项D正确,答案选D。
本题难度:一般
4、选择题 某同学按下图所示的装置进行电解实验.下列说法正确的是?

[? ]
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
参考答案:BC
本题解析:
本题难度:一般
5、填空题 (14分)二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)国外学者提出的由CO2制取C的太阳能工艺如图所示

①“热分解系统”发生的反应为2Fe3O4 6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为 。
6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为 。
②“重整系统”发生反应的化学方程式为 。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)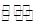 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
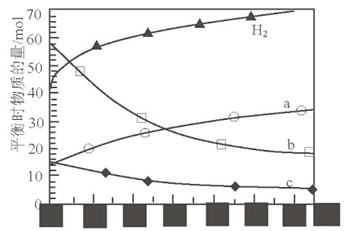
①曲线b表示的物质为 (写化学式)。
②该反应的△H 0(填:“>” 或“<”)
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 (列举l项)。
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有 (写出其中两种形式即可)。
②电解时其中b极上生成乙烯的电极反应式为 。
参考答案:(1)①2mol;② 6FeO+CO2 2Fe3O4+C;
2Fe3O4+C;
(2) ①H2O;②<;③增大压强或增大n(H2)/n(CO2)的比值;
(3) ①太阳能转化为电能、电能转化为化学能;②2CO2+12H++12e- C2H4+4H2O。
C2H4+4H2O。
本题解析:(1)①反应2Fe3O4 6FeO+O2↑中氧元素的化合价由—2价升高为0价,每生成1mol氧气转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol;②根据题给转化关系知,“重整系统”发生反应为氧化亚铁和二氧化碳在700K时发生反应生成四氧化三铁和一氧化碳,化学方程式为6FeO+CO2
6FeO+O2↑中氧元素的化合价由—2价升高为0价,每生成1mol氧气转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol;②根据题给转化关系知,“重整系统”发生反应为氧化亚铁和二氧化碳在700K时发生反应生成四氧化三铁和一氧化碳,化学方程式为6FeO+CO2 2Fe3O4+C;(2)①根据题给图像知,平衡时氢气的物质的量随温度的升高而增大,则曲线a代表反应物CO2,曲线b、c表示生成物,又曲线b表示的物质平衡时物质的量大,结合方程式分析,曲线b表示的物质为H2O;②根据题给图像知,平衡时氢气的物质的量随温度的升高而增大,平衡逆向移动,该反应的△H<0;③该反应为气体物质的量减小的放热反应,为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或增大n(H2)/n(CO2)的比值;(3)①根据题给装置图分析,该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能;②电解时b为电解池的阴极,发生还原反应,CO2得电子生成乙烯,电解质溶液呈酸性,利用H+和水平衡电荷和原子,其中b极上生成乙烯的电极反应式为2CO2+12H++12e-
2Fe3O4+C;(2)①根据题给图像知,平衡时氢气的物质的量随温度的升高而增大,则曲线a代表反应物CO2,曲线b、c表示生成物,又曲线b表示的物质平衡时物质的量大,结合方程式分析,曲线b表示的物质为H2O;②根据题给图像知,平衡时氢气的物质的量随温度的升高而增大,平衡逆向移动,该反应的△H<0;③该反应为气体物质的量减小的放热反应,为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或增大n(H2)/n(CO2)的比值;(3)①根据题给装置图分析,该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能;②电解时b为电解池的阴极,发生还原反应,CO2得电子生成乙烯,电解质溶液呈酸性,利用H+和水平衡电荷和原子,其中b极上生成乙烯的电极反应式为2CO2+12H++12e- C2H4+4H2O。
C2H4+4H2O。
考点:以二氧化碳的再利用为载体考查氧化还原反应,化学方程式、电极反应式的书写,化学平衡。
本题难度:困难