微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X,Y,Z三种气体,把a molX和b molY充入一密闭容器中,发生反应:X+2Y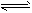 2Z 达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
2Z 达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
[? ]
A.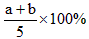
B.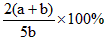
C.
D.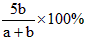
参考答案:B
本题解析:
本题难度:一般
2、选择题 在密闭容器中发生如下反应:m A(g) +n B(g) 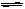 p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是
p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是
A.m + n < p
B.平衡向逆反应方向移动
C.A的转化率降低
D.C的体积分数增加
参考答案:D
本题解析:将容器体积缩小到原来的1/2的瞬间,C的浓度为原来的2倍。但最终平衡时,C的浓度为原来的1.8倍,这说明增大压强平衡向逆反应方向移动,即正反应是体积减小的可逆反应,因此选项D不正确,其余都是正确的,答案选D。
本题难度:一般
3、填空题
Ⅰ.在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中(如图)发生以下的反应:
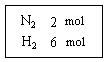
N2(g)+3 H2(g)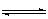 2NH3 (g)?(正反应为放热反应)
2NH3 (g)?(正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向?方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是?。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是?
Ⅱ.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g) ?2 SO3(g)。根据下列要求填写空白:
?2 SO3(g)。根据下列要求填写空白:

(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA?PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在?处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol , 则x和y 的关系是x ?y. (填“<”、“=”、“>”)。
参考答案:Ⅰ、(1)b="__3____" mol,? __逆反应__?方向进行(2)1<c<4?
(3)措施是? :降低温度
Ⅱ、(1)PA? < PB。? (2)在? 3?处。? (3)x? <? y.
本题解析:略
本题难度:简单
4、选择题 在一恒容密封容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g),下图所示是某一段时间内反应速率与反应进程的曲线关系图。完成下列问题:
2SO3(g),下图所示是某一段时间内反应速率与反应进程的曲线关系图。完成下列问题:
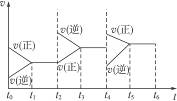
(1)处于平衡状态的时间段有____________。
(2)起始时投入的物质成分为____________。
A.SO2,O2
B.SO2,SO3
C.SO3
D.SO2,O2,SO3