微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (l2分)一定条件下,在体积为3L的密闭容器中反 应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态。
应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态。
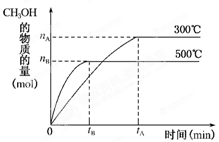
(1)500℃时,从反应开始到达到化学平衡状态,以H2的浓度变化表示的化学反应速率是________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。a.?v生成(CH3OH)=v消耗(CO),? b. 混合气体的密度不再改变
c. 混合气体的平均相对分子质量不再改变? d. CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a. c(H2)减小?b. 正反应速率加快,逆反应速率减慢,
c. CH3OH的物质的量增加? d. 重新达到平衡时,c(H2)/c(CH3OH)减小
(4) 该反应的ΔH?0(选填>、<),理由是?。
2、填空题 (16分)化学学科中的平衡理论主要内 容包括:化学平衡、电离平衡、水解平衡和
容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g)?△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g)?△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是?;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是?。
①增加C的物质的量②加压?③升温④使用催化剂
(2)反应C(s)+CO (g)
(g)  2CO(g)平衡常数K的表达式为?;
2CO(g)平衡常数K的表达式为?;
已知C(s)+H 0(g)t
0(g)t CO(g)+H
CO(g)+H ?(g)的平衡常数为K1;H
?(g)的平衡常数为K1;H (g)+CO
(g)+CO (g)
(g)  C0(g)
C0(g)
+H 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K 与K
与K 、K
、K 二者的关系为?。
二者的关系为?。
(3)已知某温度下,反应2SO +0
+0
 2S0
2S0 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO )=lmol·L
)=lmol·L c0(O
c0(O )=1mol·L
)=1mol·L ,当反应在该温度下SO
,当反应在该温度下SO 转化率
转化率
为80%时,该反应??(填“是”或“否”)达到化学平衡状态,若未达到,向 ??
??
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g)  cC(g)+riD(g)△H=
cC(g)+riD(g)△H= kJ·mol
kJ·mol ;若
;若 +b>
+b>
c+d,增大压强平衡向??(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则 ?0(填“>”或“<”)。
?0(填“>”或“<”)。
3、简答题 计算题:在密闭容器中进行的如下反应:2SO2(g)+O2(g)?2SO3(g).SO2的起始浓度是0.4mol/l,O2的起始浓度是1mol/l,当SO2的转化率为50%时,反应达到平衡状态.
(1)求SO2的转化浓度
(2)求反应的平衡常数?
(3)求O2的转化率.
4、填空题 (16分)Ⅰ.在一定条件下,xA+yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向?方向移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为?。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g)? ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
N2O4(g)? ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
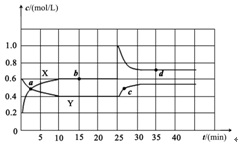
(1)图中共有两条曲线X和Y,其中曲线?表示NO2浓度随时间的变化;
a、b、c、d四个点中,表示化学反应处于平衡状态的点是?。
下列不能说明该反应已达到平衡状态的是?。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子量不随时间变化而改变
(2)前10min内用NO2表示的化学反应速率v(NO2)=?。
(3)反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是?(用文字表达);
(4)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是?。
A.加入催化剂? B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
5、选择题 在一定条件下,在体积为VL的密闭容器中发生反应:mA + nB=pC。t秒末,A减少了1mol,B减少了
1.25mol,C增加了0.5mol。则m ∶ n ∶ p应为
[? ]
A.4∶ 5∶ 2
B.2∶ 5∶ 4
C.1∶ 3∶ 2
D.3∶ 2∶ 1