微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能说明一定是金属元素的事实是( )
A.原子最外层只有1个电子的元素
B.在化学反应中能失去电子的原子
C.在化合物中只有正价没有负价的元素
D.能跟非金属反应的物质
参考答案:A.最外层只有一个电子的元素如氢元素,属于非金属元素,故A错误;
B.氢易失去电子,但属于非金属元素,所以在化学反应中能失去电子的原子不一定是金属原子,故B错误;
C.金属元素的原子易失电子形成阳离子,即金属元素只有正化合价,没有负价,故C正确;
D.非金属之间也能发生反应,所以能跟非金属反应的物质不一定是金属元素,故D错误;
故选:C.
本题解析:
本题难度:简单
2、选择题 A、B、C、D四种元素的原子序数依次增大,且均小于18.B、C元素原子的最外层电子数之和等于D元素原子的最外层电子数,A、C同主族且C元素原子的核外电子数是A元素原子核内质子数的两倍.下列叙述不正确的是( )
A.离子半径:C>D>A>B
B.气态氢化物的稳定性:A>C>D
C.B分别与A、C、D可形成四种化合物
D.B分别与A、C、D形成的化合物中只含离子键
参考答案:A、B、C、D四种元素的原子序数依次增大,且均小于18,A、C同主族且C元素原子的核外电子数是A元素原子核内质子数的两倍,则A为O,C为S;B、C元素原子的最外层电子数之和等于D元素原子的最外层电子数,C的最外层电子数为6,则B的最外层电子数为1,D的最外层电子数为7,则B为Na,D为Cl,
A.电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为C>D>A>B,故A正确;
B.非金属性越强,气态氢化物越稳定,则稳定性为A>D>C,故B错误;
C.B分别与A、C、D可形成四种化合物氧化钠、过氧化钠、硫化钠、氯化钠四种化合物,故C正确;
D.B分别与A、C、D形成的化合物中过氧化钠含有离子键和非极性共价键,故D错误;
故选BD.
本题解析:
本题难度:简单
3、填空题 现有元素周期表中前20号五种元素:A、B、C、D、E,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.9g?D的单质跟足量盐酸反应,生成D3+和1.12L(标况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)写出各元素符号:
A______,B______,C______,D______,E______.
(2)B、D的最高价氧化物对应水化物相互反应的离子方程式为:______.
(3)用电子式表示C与E形成E2C的过程:______.
参考答案:现有元素周期表中前20号五种元素:A、B、C、D、E.A的原子核中没有中子,则A为氢元素;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5,令B、C质子数分别为x、y,则x+y=27,y-x=5,解得x=11,y=16,故B为钠元素,C为硫元素;0.9g?D的单质跟足量盐酸反应,生成D3+和1.12L(标况)氢气,令D的相对分子质量为z,则0.9z×3=1.12L22.4L/mol×2,解得z=27,则D为铝元素;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构,E形成+1价离子,离子核外有18个电子,则E为钾元素,故A为氢元素;B为钠元素;C为硫元素;D为铝元素;E为钾元素.
(1)由分析可知,A为H元素;B为Na元素;C为S元素;D为Al元素;E为K元素,故答案为:H;Na;S;Al;K;
(2)B、D的最高价氧化物对应水化物为NaOH、Al(OH)3,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,二者相互反应的离子方程式为OH-﹢Al(OH)3=AlO2-﹢2H2O,
故答案为:OH-﹢Al(OH)3=AlO2-﹢2H2O;
(3)K2S是离子化合物,由钾离子与硫离子构成,用电子式表示K2S的形成过程为
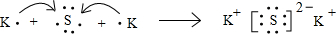
,
故答案为:
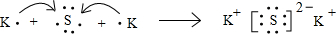
.
本题解析:
本题难度:一般
4、选择题 下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素?③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族.
A.①②
B.①③
C.②④
D.③④
参考答案:C
本题解析:
本题难度:简单
5、填空题 已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)X、Y、Z、W四种元素的名称:Y______、W______
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为
______.
(3)由X、Y、Z所形成的离子化合物与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是______.
(4)由X、Y形成的化合物XY5属于______晶体,写出XY5和水的反应方程式______.
参考答案:(1)Y的氢化物分子中有3个共价键,Y应为N元素,Z原子最外层电子数是次外层电子数的3倍,则Z为O元素,W原子的质子数等于Y、Z原子最外层电子数之和,则W为Na元素,X、W同主族,且原子序数最小,为H元素,故答案为:氮、钠;
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物分别是氨、氧化钠以及过氧化钠,其电子式分别为:
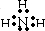
、

、
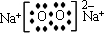
,故答案为:
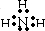
、

、
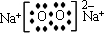
;
(3)由X、Y、Z所形成的离子化合物为NH4NO3,W的最高氧化物的水化物为NaOH,二者在加热条件反应生成氨气,
反应的离子方程式为NH4++OH-?△?.?NH3↑+H2O,故答案为:NH4++OH-?△?.?NH3↑+H2O;
(4)Y形成的化合物XY5属于离子晶体,为NH4H,含有-1价的H元素,具有强还原性,与水反应生成氢气,反应的化学方程式为NH4H+H2O═NH3?H2O+H2↑,
故答案为:离子;NH4H+H2O═NH3?H2O+H2↑.
本题解析:
本题难度:一般