微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 短周期元素X、Y、Z可组成化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Y是短周期中原子半径最大的元素,Z原子的最外层电子数是次外层电子数的2倍.试回答:
(1)X、Y元素的名称:X______;?Y______.
(2)元素X的一种核素有10个中子,该核素可表示为______.
(3)Y2X对应水化物的电子式______,ZX2的电子式为______.
(4)写出Y2X溶于水的溶液与ZX2反应生成化合物Y2ZX3的离子方程式______.
(5)一定量的Y2X2与ZX2反应后得到固体物质A,A恰好与含0.8molHCl的稀盐酸完全反应并收集到0.25mol气体,则用______物质的量表示A的组成为:______.
参考答案:(1)Y是短周期中原子半径最大的元素,则Y为Na;Z原子的最外层电子数是次外层电子数的2倍,则Z为C,三种元素原子的质子总数为25,则X为O.故答案为:氧? 钠;
(2)X的质子数为8,含有10个中子的核素质量数为18,该核素可表示为
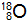
,故答案为:
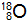
;
(3)氧化钠的水化物是氢氧化钠,属于离子化合物,写电子式时,阴离子用中括号括起来,二氧化碳是共价化合物,碳原子形成4个共价键,Y2X对应水化物的电子式为
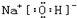
,ZX2的电子式为为
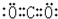
,
故答案为:
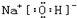
?
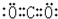
;
(4)二氧化碳与氢氧化钠溶液反应生产碳酸钠和水,反应的方程式为2OH-+CO2=CO32-+H2O,
故答案为:2OH-+CO2=CO32-+H2O;
(5)过氧化钠与二氧化碳反应生成的A中含碳酸钠,还可能含有没有反应的过氧化钠,设A中含碳酸钠的物质的量是x,过氧化钠物质的量是y,据气体物质的量得:12y+x=0.25? ①
据钠、氯守恒得:2x+2y=0.8? ②,联立①②解得x=0.1? y=0.3,故答案为:0.3molNa2O2,0.1molNa2CO3
本题解析:
本题难度:一般
2、简答题 有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体;B原子最外层电子数是次外层电子数的3倍,C?2+与B元素的离子具有相同的电子层结构;D与E原子具有相同的电子层数,且次外层电子数均为8;在同周期主族元素中原子半径E最大,D最小.回答下列问题:
(1)C?2+离子与D原子的结构示意图分别为:______、______.
(2)B和E形成的两种化合物的电子式是:______、______
其中之一可与A?和B形成的化合物反应得到游离态B,写出该反应的化学方程式:______.
(3)由这五种元素中的几种形成的化合物中碱性最强的是______(化学式),含氧酸酸性最强的是______(化学式).
参考答案:有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体,则A为H元素;B原子最外层电子数是次外层电子数的3倍,则最外层电子数为6,即B为O元素;C?2+与B元素的离子具有相同的电子层结构,则C的质子数为8+2+2=12,即C为Mg元素;D与E原子具有相同的电子层数,且次外层电子数均为8,则D、E均在第三周期,在同周期主族元素中原子半径E最大,D最小,则E为Na,D为Cl,
(1)镁离子的结构示意图为
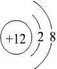
,氯原子的结构示意图为

,故答案为:

;

;
(2)B和E形成的两种化合物为Na2O、Na2O2,电子式分别为
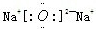
、
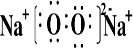
,过氧化钠与水反应生成氧气,反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑,
故答案为:
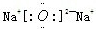
;
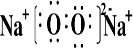
;2Na2O2+2H2O=4NaOH+O2↑;
(3)五种元素中,Na的金属性最强,则NaOH的碱性最强;Cl的非金属性最强,则HClO4的酸性最强,
故答案为:NaOH;HClO4.
本题解析:
本题难度:一般
3、简答题 现有下列短周期元素性质的相关数据:
| ① | ② | ③ | ④ | ⑤ | ⑥
原子半径(10-10m)
1.30
0.82
0.99
1.11
0.90
1.18
|
最高或最低化合价
+2
+3
+7
+4
+2
+3
-1
-4
|
请回答下列问题:
(1)①和③形成的化合物类型为______(填“离子”或“共价”)化合物;
(2)元素①的金属性比元素⑥要______(填“强”或“弱”),试从原子结构方面解释其原因:______;
(3)在自然界中,元素④的存在形态为______,工业上粗制该元素单质的化学方程式为______;
(4)⑥的单质与浓NaOH溶液反应的离子方程式是______;
(5)实验室现有元素①的单质和某未知金属单质M,请简要写出比较两者金属性强弱的一种实验方案______.
参考答案:由同周期元素的原子半径从左向右在减小,同主族元素的原子半径从上到下在增大,再结合短周期元素的最高或最低化合价可知,③为Cl,①为Mg,⑥为Al,④为Si,
(1)①和③形成的化合物为氯化镁,构成微粒为离子,则属于离子化合物,故答案为:离子;
(2)同周期元素的金属性从左向右在减小,则Mg的金属性比铝的强,是因为镁的原子半径大于铝,原子核对最外层电子的吸引力比铝弱,比铝原子更容易失去电子,所以镁元素的金属性比铝要强,故答案为:强;镁的原子半径大于铝,原子核对最外层电子的吸引力比铝弱,比铝原子更容易失去电子,所以镁元素的金属性比铝要强;
(3)在自然界中,Si元素以化合态存在,工业上粗制硅的反应为SiO2+2C?高温?.?Si+2CO↑,
故答案为:化合态;SiO2+2C?高温?.?Si+2CO↑;
(4)Al与NaOH溶液反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)利用不同金属与水或与酸反应,反应剧烈的金属性强,则在两个小烧杯中分别加入适量蒸馏水(或等浓度的盐酸),然后投入形状大小相同的金属片,若M反应比镁剧烈,则M的金属性比Mg强,故答案为:在两个小烧杯中分别加入适量蒸馏水(或等浓度的盐酸),然后投入形状大小相同的金属片,若M反应比镁剧烈,则M的金属性比Mg强.
本题解析:
本题难度:一般
4、选择题 以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
[? ]
A.He
B.
C.1s2
D.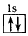
参考答案:D
本题解析:
本题难度:简单
5、简答题 Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是______
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是______.
A.稳定性:甲>乙,沸点:甲>乙?B.稳定性:甲>乙,沸点:甲<乙
C.稳定性:甲<乙,沸点:甲<乙?D.稳定性:甲<乙,沸点:甲>乙
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为______(用元素符号作答).
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为______.
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为______,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为______.
参考答案:Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,为O元素,Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,
(1)Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,Cu原子失去4s能级的1个电子及3d能级中的1个电子形成Cu2+,Cu2+的核外电子排布式是1s22s22p63s23p63d9,故答案为:1s22s22p63s23p63d9;
(2)Q形成的最简单气态氢化物甲为CH4,Y形成的最简单气态氢化物乙为SiH4,非金属性C>Si,故稳定性CH4>SiH4
,二者结构相似,都可以形成分子晶体,相对分子质量越大,沸点越高,故沸点CH4<SiH4,
故答案为:B;
(3)同周期自左而右第一电离能增大趋势,同主族自上而下第一电离能降低,故第一电离能Si<C<N,
故答案为:Si<C<N;
(4)非金属性Si<C<N<O,非金属性越强,电负性越大,故电负性最大元素是O元素,电负性最小的非金属元素为Si,二者形成的化合物为SiO2,故答案为:SiO2;
(5)C元素的一种氢化物相对分子质量为28,该氢化物为C2H4,分子中含有4个C-H单键、1个C=C双键,单键是σ键,双键中有1个σ键、1个π键,故分子中有5个σ键、1个π键,分子中的σ键与π键的键数之比为5:1,乙烯与氧气形成的燃料电池在碱性电解质中,负极发生氧化反应,乙烯在负极放电,碱性条件下生成碳酸根离子与水,电极反应式为:
C2H4+16OH--12e-=2CO32-+10H2O,故答案为:5:1,C2H4+16OH--12e-=2CO32-+10H2O.
本题解析:
本题难度:一般