微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3?+14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:

④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:

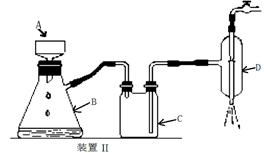
⑤制备过程中可能用到的部分装置如下:
 ?
? ?
? ?
?
请回答下列问题:
(1)操作B的名称是 ?,操作A后所弃去的沉淀中一定有 ?。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为?。原料NH4Cl的主要作用有:① ?;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ?;②使反应温和进行。
(4)操作A的名称为 ?,进行该操作的装置是?(填序号)。
A.装置Ⅰ? B.装置Ⅱ? C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是?。
装置Ⅱ中仪器A、B、C、D的名称分别是?、?、?、?。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 ?洗涤。
A. 饱和氯化钠溶液? B. 无水乙醇? C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些??。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3还是
[Co(NH3)5Cl]Cl2的实验方案: ?。
参考答案:(1)烘干;活性炭 (2)Co2++2NH3·H2O=Co(OH)2↓+ 2NH4+ ;抑制NH3·H2O的电离
(3)避免H2O2的分解?(4)趁热过滤;A;用滤液清洗;布氏漏斗;吸滤瓶;安全瓶;抽气泵
(5)C? B?(6)①煮沸20min,使反应完全 ?②整个过程温度的控制,因为温度不同,产物不同
③最后加入的7mL浓盐酸,因为借助同离子效应使产品析出
(7)取等质量的晶体分别溶于水,室温下加足量的AgNO3溶液后,滤去沉淀,对滤液再进行加热,又能产生沉淀的是[Co(NH3)5 Cl]Cl2,不能再产生沉淀的是[Co(NH3)6 ]Cl3
本题解析:(1)抽滤后得到的产品中含有水分,需要烘干,因此操作B的名称是烘干;反应中需要活性炭作催化剂,而活性炭不溶于水,所以操作A后所弃去的沉淀中一定有活性炭。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该蓝色沉淀是氢氧化钴,该反应的离子方程式为Co2++2NH3·H2O=Co(OH)2↓+ 2NH4+ ;在碱性条件下容易生成氢氧化钴沉淀,因此原料NH4Cl的主要作用除了提供NH3以外,还有抑制NH3·H2O的电离,降低溶液的碱性。
(3)由于双氧水不稳定,受热易分解,因此冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的是避免H2O2的分解,另外使反应温和进行。
(4)由于温度不同,产物也不同,因此操作A应该是趁热过滤;由于需要保持一定温度,所以选择装置I,即答案选A;若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是用滤液清洗;根据仪器的构造特点可知装置Ⅱ中仪器A、B、C、D的名称分别是布氏漏斗;吸滤瓶;安全瓶;抽气泵。
(5)增大氯离子浓度可以防止产品溶解而损失,因此三氯化六氨合钴首先应该用浓盐酸洗涤,最后再用有机溶剂乙醇洗涤,故答案为C、B。
(6)根据以上分析可知实验提高产率的关键步骤①煮沸20min,使反应完全;②整个过程温度的控制,因为温度不同,产物不同;③最后加入的7mL浓盐酸,因为借助同离子效应使产品析出。
(7)根据结构可知,氯离子作为配体的数目是不同的,且温度不同,产品不同,据此可以验证,即取等质量的晶体分别溶于水,室温下加足量的AgNO3溶液后,滤去沉淀,对滤液再进行加热,又能产生沉淀的是[Co(NH3)5 Cl]Cl2,不能再产生沉淀的是[Co(NH3)6 ]Cl3。
本题难度:一般
2、实验题 (14分)制取氨气并完成喷泉实验(图中夹持装置均已略去)
⑴写出实验室制取氨气的化学反应方程式:
?
⑵收集氨气应使用?法,要得到干燥的氨气可选用?做干燥剂。
⑶收集氨气时,验满的方法是?。
⑷用下图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操是?,该实验的原理是?。
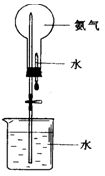
⑸假设烧瓶充满标况下的氨气,喷泉实验后溶液充满整个烧瓶,所得溶液物质的量浓度为?。
参考答案:(14分)每空2分
⑴2NH4Cl(固) + Ca(OH)2(固)  CaCl2 + 2NH3↑ +2H2O
CaCl2 + 2NH3↑ +2H2O
⑵向下排空气法;碱石灰(CaO等合理即可)
⑶将湿润的红色石蕊试纸置于试管口变蓝(其他合理答案均可)
⑷挤按含水的胶头滴管;NH3极易溶于水,使烧瓶内外产生气压差。
⑸0.045mol/L或1/22.4mol/L
本题解析:喷泉实验成败的关键是气密性良好,能够在短时间内产生一个压强差。故引发可以挤压胶头滴管,让氨气快速溶于水,产生压强差。最后水充满烧瓶,设烧瓶体积为V,有c==mol/L
本题难度:一般
3、实验题 (共16分)
Ⅰ实验室制备1,2-二溴乙烷的反应原理如下:
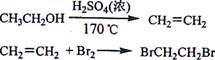
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
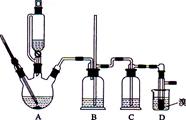
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
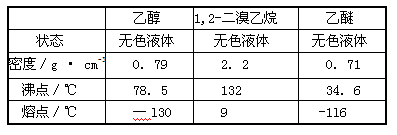
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是?;(填正确选项前的字母)
a.引发反应? b.加快反应速度? c.防止乙醇挥发? d.减少副产物乙醚生成
(2)在装置C中应加入?,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水? b.浓硫酸? c.氢氧化钠溶液? d.饱和碳酸氢钠溶液?
(3)若产物中有少量副产物乙醚.可用?的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是??。
Ⅱ.已知烯烃与苯在一定条件下反应生成芳香烃。如:
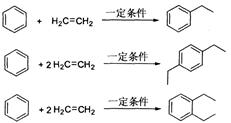
丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途。
(1)写出丙烯在一定条件下发生聚合反应的化学方程式?。
(2)丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%。A的分子式为?。
(3)丙烯与苯在一定条件下反应可生成D、E、F等多种芳香烃。红外光谱、核磁共振是研究有机物结构的重要方法,根据下列数据,画出D、E的结构。
D:元素组成:C89.94%、H10.06%;1H核磁共振有5个信号。
E:元素组成:C88.82%、H11.18%;1H核磁共振有3个信号。
F:元素组成:C88.82%、H11.18%;1H核磁共振有4个信号。
D:?。?E:?。
参考答案:(每空2分,共16分)
Ⅰ: (1)d?(2)c?(3)蒸馏
(4)产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管。
Ⅱ
(1) (2分)
(2分)
(2) C5H8O2
(3) 
本题解析:Ⅰ(1)已知乙醇在浓硫酸的存在下在l40℃脱水生成乙醚,故迅速地把反应温度提高到170℃左右的主要目的是减少副产物乙醚生成,故选d。
(2)酸性气体是二氧化硫,故c中应加入氢氧化钠溶液,故选c。
(3)乙醚和1,2-二溴乙烷的沸点相差很大,故可用蒸馏的方法除去副产物乙醚。
(4)由表中可知1,2-二溴乙烷的熔点为9℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管。
Ⅱ(1)丙烯与乙烯都含有碳碳双键,聚合反应的原理是相同的,故化学方程式为: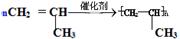 。
。
(2)A的相对分子质量为16*6.25=100,经过计算C、H、O的物质的量分别为5mol、8mol、2mol,故A的分子式为C5H8O2。
(3)D:H原子有5种等效氢,经过计算是一个丙烯与苯发生的反应,结构式为: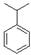 。
。
E:H原子有3种等效氢,经过计算是二个丙烯与苯发生的反应,结构式为: 。
。
点评:本题以实验题的形式考查了有机物的性质,难度适中,注意分析题中所给出的信息,便能解答此题。
本题难度:一般
4、实验题 (10分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室也可以制取乙酸乙酯,并使用饱和碳酸钠溶液承接。回答下列问题:
(1)饱和碳酸钠溶液的主要作用是?。
(2)写出乙醇具有下列性质的化学反应方程式
①制取乙酸乙酯?。
②与金属钠反应?。
③催化氧化生成乙醛?。
(3) 生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度相等?
⑥反应不再继续进行
参考答案:(1)中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯。
(2)CH3COOH + CH3CH2OH 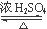 CH3COOCH2CH3?+ H2O
CH3COOCH2CH3?+ H2O
2CH3CH2OH+2Na→2CH3CH2ONa+H2?2CH3CH2OH+O2→2CH3CHO+H2O
(5)②④
本题解析:(1)由于生成的乙酸乙酯中含有乙酸和乙醇,所以通过饱和碳酸钠溶液来除去杂质。其作用是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯。
(2)乙醇含有羟基,能发生酯化反应,能和金属钠反应生成氢气,也能发生催化氧化生成乙醛,方程式分别为CH3COOH + CH3CH2OH 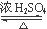 CH3COOCH2CH3?+ H2O、
CH3COOCH2CH3?+ H2O、
2CH3CH2OH+2Na→2CH3CH2ONa+H2、2CH3CH2OH+O2→2CH3CHO+H2O。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以④正确,⑥不正确。①、③中反应速率的方向是相同的,不正确。②中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项⑤不正确。答案选②④。
本题难度:一般
5、实验题 (10 分)结合下列实验装置图回答问题:
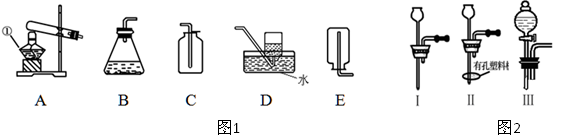
(1)某课外活动小组的同学用图1装置探究CO2的实验室制法:
①甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是?,收集装置是?。
②加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 ?Na2CO3 + H2O +CO2↑
?Na2CO3 + H2O +CO2↑
NH4HCO3 ?NH3 ↑+ H2O +CO2↑
?NH3 ↑+ H2O +CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是?。
他不选用碳酸氢铵制取CO2的理由是?。
(2)图1中装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
参考答案:(1)①B(2分) C(2分)②A(2分)碳酸氢铵加热分解会产生CO2和NH3的混合气体,从而制得的CO2不纯。(2分)
(2)III(2分)
本题解析:(1)①大理石与盐酸反应,不需要加热,所以选择B装置。CO2能溶于水,但密度大于空气的,所以应该用向上排气法收集,答案选C。
②由于碳酸氢钠分解需要加热,且碳酸氢钠是固体,所以应该选择装置A;由于碳酸氢铵加热分解会产生CO2和NH3的混合气体,从而制得的CO2不纯,所以不选用碳酸氢铵制取CO2。
(2)要想控制反应速率,则必须选择分液漏斗,即选择装置Ⅲ。
本题难度:一般