微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下:?

(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: ? 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 ? 。
温度/℃
| 20
| 40
| 60
| 80
|
KIO3g/100g水
| 8.08
| 12.6
| 18.3
| 24.8
|
【问题2】已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;? I2+2S2O32-=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有? ?。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是?mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤
| 实验现象
|
取1g纯净的NaCl,加3mL水配成溶液。
| 溶液无变化
|
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。
| 溶液无变化
|
然后再滴入1滴1mol/L的H2SO4,振荡。
| 溶液变蓝色
|
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示?。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:?。
2、选择题 通常情况下能共存,且能用浓硫酸干燥的一组气体是
A.H2 O2 N2
B.O2 NO NO2
C.H2 N2 NH3
D.NH3 HCl NO2
3、选择题 右图是一套实验室制备气体的装置,用于发生、干燥、收集和吸收有毒气体。下列各组物质能利用这套装置进行实验的是
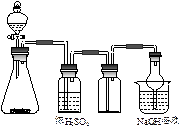
A.电石和水
B.MnO2和浓盐酸
C.Cu片和浓硝酸
D.Na2SO3和浓硫酸
4、实验题 (18分)实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目
?。
(2)B处盛有饱和食盐水(或水),其作用是?。
(3)C处盛放的试剂__________(填名称),其作用是?。
(4)E处盛有_______(填名称),发生反应的离子方程式为?。
(5)实验结束时,应先熄灭__________处酒精灯。
5、填空题 (10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
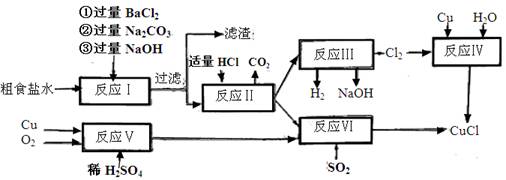
(1)反应I中加Na2CO3溶液的作用是?。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为?。
(3)①写出反应V的化学方程式?
②写出反应VI的离子反应方程式?。
(4)在整个合成过程中可以循环利用的物质是?
(5)反应IV加入的Cu必须过量,其目的是?。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是? ?。
?。