微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中,都是共价化合物的是(?)
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和HClO3
参考答案:D
本题解析:硫化氢中硫原子和氢原子之间只存在共价键,硫化氢是共价化合物;过氧化钠中存在离子键,属于离子化合物,故A错误;双氧水中只存在共价键,属于共价化合物;氟化钙中存在离子键,属于离子化合物,故B错误;氨气中只存在共价键,属于共价化合物;氮气中只存在共价键,但是氮气属于单质,故C错误.硝酸中只存在共价键,属于共价化合物;氯酸中只存在共价键,属于共价化合物,故D正确,为本题的答案。
点评:本题考查了共价键化合物、离子化合物,解题的关键是要立即共价化合物和离子化合物的定义,该题比较容易。
本题难度:一般
2、填空题 (14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号
| 起始时各物质物质的量/mol
| 达到平衡的时间/min
| 达平衡时体系能量的变化/kJ
|
CO
| H2O
| CO2
| H2
|
①
| 1
| 4
| 0
| 0
| t1
| 放出热量:32.8 kJ
|
②
| 2
| 8
| 0
| 0
| t2
| 放出热量:Q
|
| | | | | | |
|
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
A.平衡时,两容器中H2的体积分数相等
B.容器②中反应达平衡状态时,Q > 65.6 kJ
C.反应开始时,两容器中反应的化学反应速率相等
D.容器①中,化学反应速率为: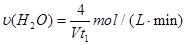
(5)已知:②2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式: 。
(6)容器①中 反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(7)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图中所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
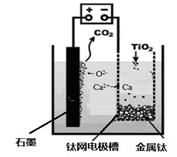
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合反应式解释) 。
参考答案:(1)小于;(2)80%。;(3)1 (4)A;(5)2CO(g) + O2(g) ="==" 2CO2(g) △H =" -566" kJ/mol
(6)3CO2 + 5OH- ="==" 2CO32- + HCO3- + 2H2O
(7)① 2O2- - 4e- ="=" O2↑或 C + 2O2- - 4e- ="=" CO2↑
②制备TiO2时,在电解槽发生如下反应:2CaO  2Ca + O2↑, 2Ca + TiO2
2Ca + O2↑, 2Ca + TiO2 Ti + 2CaO,
Ti + 2CaO,
由此可见,CaO的量不变。
或: 制备TiO2时,在电解槽发生如下反应:阴极:2Ca2+ + 4e- ="=" 2Ca ;阳极:2O2- - 4e- ="=" O2↑
2Ca + TiO2 Ti + 2CaO,,由此可见,CaO的量不变。
Ti + 2CaO,,由此可见,CaO的量不变。
本题解析:(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于生成物分子化学键形成时所释放的总能量,所以发生化学反应时放出热量。(2)容器①中反应达平衡时,32.8 kJ ÷41 kJ =0.8,所以CO的转化率为80%;(3)由于容器①、容器②中的温度不变,所以反应的平衡常数相同。K=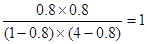 ;(4)A. 由于该容器内的反应是反应前后气体体积相等的反应,两个容器内反应物的物质的量的比相等,所以达到平衡时,两容器中为等效平衡,故H2的体积分数相等,正确;B.由于容器容器①、②是等效平衡,所以物质的量是①的2倍,放出的热量也是①的2倍,所以②中反应达平衡状态时,Q ="32.8" kJ×2=" 65.6" kJ;错误;C.反应开始时,由于②的物质的量是①的2倍,浓度越大,反应速率就越快,错误;D.化学反应速率是单位时间内物质的量浓度的改变数值,该反应是可逆反应,反应物不可能完全反应,故该选项错误。①×2+②整理可得:2CO(g) + O2(g) ="==" 2CO2(g) △H =" -566" kJ/mol;(6)n(CO2)="0.6" mol ;n(NaOH)=" 0.200L" ×5 mol/L=1mol,则n(CO2):n(NaOH)=3:5,所以化学方程式是:3CO2 + 5OH- ="==" 2CO32- + HCO3- + 2H2O;(7)①在阳极O2-失去电子,发生氧化反应,所发生反应的电极反应式是:2O2- - 4e- ="=" O2↑或写为C + 2O2- - 4e- ="=" CO2↑;②在制备金属钛前后,CaO的总量不变,其原因是制备TiO2时,在电解槽发生如下反应:阴极:2Ca2+ + 4e- ="=" 2Ca ;阳极:2O2- - 4e- ="=" O2↑;2Ca + TiO2
;(4)A. 由于该容器内的反应是反应前后气体体积相等的反应,两个容器内反应物的物质的量的比相等,所以达到平衡时,两容器中为等效平衡,故H2的体积分数相等,正确;B.由于容器容器①、②是等效平衡,所以物质的量是①的2倍,放出的热量也是①的2倍,所以②中反应达平衡状态时,Q ="32.8" kJ×2=" 65.6" kJ;错误;C.反应开始时,由于②的物质的量是①的2倍,浓度越大,反应速率就越快,错误;D.化学反应速率是单位时间内物质的量浓度的改变数值,该反应是可逆反应,反应物不可能完全反应,故该选项错误。①×2+②整理可得:2CO(g) + O2(g) ="==" 2CO2(g) △H =" -566" kJ/mol;(6)n(CO2)="0.6" mol ;n(NaOH)=" 0.200L" ×5 mol/L=1mol,则n(CO2):n(NaOH)=3:5,所以化学方程式是:3CO2 + 5OH- ="==" 2CO32- + HCO3- + 2H2O;(7)①在阳极O2-失去电子,发生氧化反应,所发生反应的电极反应式是:2O2- - 4e- ="=" O2↑或写为C + 2O2- - 4e- ="=" CO2↑;②在制备金属钛前后,CaO的总量不变,其原因是制备TiO2时,在电解槽发生如下反应:阴极:2Ca2+ + 4e- ="=" 2Ca ;阳极:2O2- - 4e- ="=" O2↑;2Ca + TiO2 Ti + 2CaO,,由此可见,CaO的量不变。
Ti + 2CaO,,由此可见,CaO的量不变。
考点:考查化学键的键能与反应热的关系、物质的平衡转化率、平衡状态的判断、离子方程式的书写、电解原理的应用的知识。
本题难度:困难
3、选择题 下列每组物质的变化过程中所克服的粒子间的相互作用属于同种类型的是( )
A.氯化氢和氯化钠溶于水
B.加热氯化铵和双氧水
C.碘和干冰升华
D.二氧化硅和氧化镁熔化
参考答案:C
本题解析:A中电离出阴阳离子,前者克服极性键,后者是离子键。B中前者是离子键和共价键,后者只有共价键。C中是物理变化,克服分子间作用力。D中前者是极性键,后者是离子键。答案选C。
本题难度:一般
4、选择题 根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)  2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(ii) I2(S)+ H2(g) 2HI(g) ΔH=+26.48 kJ/mol.
2HI(g) ΔH=+26.48 kJ/mol.
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低