微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 决定化学反应速率的主要因素是
① 温度 ② 压强 ③ 催化剂 ④ 浓度 ⑤ 反应物本身的性质
A.①②③④⑤
B.⑤
C.①④
D.①②③④
参考答案:B
本题解析:反应物本身的性质是决定化学反应速率的主要因素,其他因素都是外界条件,所以答案是B。
本题难度:困难
2、填空题 用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl(g) +O2(g) 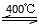 Cl2 (g)+2H2O (g)
Cl2 (g)+2H2O (g)
已知:i.反应A中, 4mol HC1被氧化,放出115.6kJ的热量。
 ii.
ii.
H2O的电子式是_______________。
反应A的热化学方程式是_______________。
③ 断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
参考答案:  ①② 4HCl(g) +O2(g)
①② 4HCl(g) +O2(g) 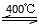 Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol③32 ; 强
Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol③32 ; 强
本题解析:①水的电子式为 ;②注意书写热化学方程式时要标明物质的状态和DH,故反应方程式为4HCl(g)+O2(g)
;②注意书写热化学方程式时要标明物质的状态和DH,故反应方程式为4HCl(g)+O2(g)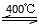 Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol;③;假设断裂1molH-Cl和1molH-O键所需能量分别为X和Y,反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有4x+498kJ-2×243kJ-2×2×y=-115.6kJ,解得y-x=31.9,H—O 键比HCl中H—Cl键强,故答案为31.9;强.
Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol;③;假设断裂1molH-Cl和1molH-O键所需能量分别为X和Y,反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有4x+498kJ-2×243kJ-2×2×y=-115.6kJ,解得y-x=31.9,H—O 键比HCl中H—Cl键强,故答案为31.9;强.
考点:化学反应中的能量变化
本题难度:一般
3、选择题 用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是
A.29.5g
B.44g
C.74.8g
D.88g
参考答案:A
本题解析:根据方程式可知,30g乙酸完全酯化需要23g乙醇,生产44g乙酸乙酯。所以实际产生的乙酸乙酯是44g×67%=29.48g,答案选A。
本题难度:一般
4、填空题 英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
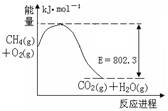
(1)右图是1molCH4和O2完全反应生成CO2气体与水蒸气过程中能量变化示意图,又已知 H2O(l)=H2O(g) △H=44.0kJ·mol-1,请写出1molCH4和O2完全反应生成CO2气体与液态水的热化学方程式?。?
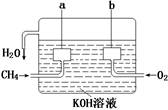
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
①请写出甲烷燃料电池中a极的电极反应式为?。
②此时电池内的总反应方程式为?。
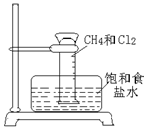
(3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
①CH4与Cl2发生反应的条件是?;若用日光直射,可能会引起?。
②实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,?,?等。
③用饱和食盐水而不用谁的原因是?。
④实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2→2COCl2+2HCl,上述反应?(填选项符号,下同)
A.属于取代反应? B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是?
A.氢氧化钠溶液? B.硝酸银溶液? C.稀盐酸?
D.水? E.湿润的蓝色石蕊试纸?F.湿润的无色酚酞试纸
参考答案:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ·mol-1;(2)①CH4+10OH-=CO32-+7H2O+8e-;②CH4+2O2+2KOH=K2CO3+7H2O
本题解析:依据燃料电池的电极及电极反应可知a、b两极各是什么极及其电极反应式。又由于甲烷燃烧生成二氧化碳,但在KOH溶液中应生成碳酸根离子,又碳元素的化合价由-4升高到+4,故1mol的甲烷应失去8mol的电子,即电极反应式为:CH4+10OH-=CO32-+ 7H2O+8 e-。(3)①光照(或光亮处)?爆炸②量筒内黄绿色气体颜色变浅?量筒内液面上升③降低Cl2在水中溶解度,抑制Cl2和水的反应?④B?BE解析:CH4和Cl2光照反应生成CH3Cl、CH2Cl2、CHCl3、CCl4、HCl等物质,随着反应进行,Cl2不断消耗,黄绿色逐渐消失。又由于生成的CH2Cl2、CHCl3、CCl4常温下是无色液体,且Cl2易溶于有机溶剂,故量筒内壁上有油滴。因生成的HCl易溶于水,量筒内的压强减小,;量筒内页面上升。HCl溶于水后,溶液中Cl-浓度增大,使NaCl固体析出。
本题难度:简单
5、填空题 (5分)用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+??Cl ??
⑵ 写出下列物质的结构式:N2 ??CO2??
⑶ 用电子式表示NaOH_______________________
参考答案:略
本题解析:(1)电子式是在元素符号周围用×或点表示元素原子的最外层电子,故阳离子Al3+本身就是它的电子式,氯原子最外层有7个电子,在Cl元素符号周围写上7个电子即为电子式;(2)氮气分子中存在氮氮三键,故结构式为:N≡N;二氧化碳中碳和氧之间是碳氧双键,故结构式为:O=C=0;(3)离子化合物的电子式表示出阳离子和阴离子,钠离子的电子式就是钠离子本身,写上氢氧根离子的电子式即得氢氧化钠的电子式。
本题难度:一般