微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中,都是共价化合物的是(?)
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和HClO3
2、填空题 (14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号
| 起始时各物质物质的量/mol
| 达到平衡的时间/min
| 达平衡时体系能量的变化/kJ
|
CO
| H2O
| CO2
| H2
|
①
| 1
| 4
| 0
| 0
| t1
| 放出热量:32.8 kJ
|
②
| 2
| 8
| 0
| 0
| t2
| 放出热量:Q
|
| | | | | | |
|
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
A.平衡时,两容器中H2的体积分数相等
B.容器②中反应达平衡状态时,Q > 65.6 kJ
C.反应开始时,两容器中反应的化学反应速率相等
D.容器①中,化学反应速率为: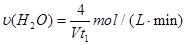
(5)已知:②2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式: 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(7)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图中所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
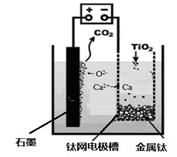
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合反应式解释) 。
3、选择题 下列每组物质的变化过程中所克服的粒子间的相互作用属于同种类型的是( )
A.氯化氢和氯化钠溶于水
B.加热氯化铵和双氧水
C.碘和干冰升华
D.二氧化硅和氧化镁熔化
4、选择题 根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)  2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(ii) I2(S)+ H2(g) 2HI(g) ΔH=+26.48 kJ/mol.
2HI(g) ΔH=+26.48 kJ/mol.
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低