微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列相关实验不能达到预期目的的是
[? ]
相关实验?
预期目的
A.
相同温度下,等质量的大理石块、大理石粉
分别与等体积、等浓度的盐酸反应
探究接触面积对化学反应速率的影响
B.
把装有颜色相同的NO2和N2O4混合气的两支
试管(密封)分别浸入冷水和热水中
探究温度对化学平衡的影响
C.
在蔗糖中加入稀硫酸,水浴加热,再加入新
制的氢氧化铜并加热
探究蔗糖水解产物具有还原性
D.
两支试管中装有等体积、等浓度H2O2溶液,
向其中一支试管中加入CuSO4溶液
探究CuSO4溶液对H2O2分解速率的影响
2、实验题 两个学习小组用下图装置探究乙二酸(HOOC-COOH)受热分解的部分产物。
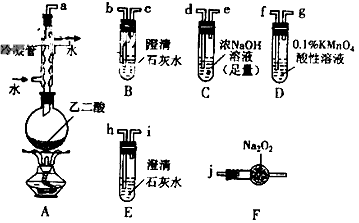
(1)甲组:
①按接口顺序:a-b-c-d-e-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有______________________;装置C的作用是______________________;E中溶液变浑浊,D中的现象是___________,证明分解产物有___________。
②乙二酸受热分解的化学方程式为___________。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为______________________。
②从A-F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。最简单的装置接口连接顺序是
___________ ;实验后用F中的固体进行验证的方法是___________(可另选试剂)。
3、实验题 请设计CO2在高温下与木炭反应生成CO的实验。
(1)在图2中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B,C……;其他可选用的仪器(数量不限)简易表示如图1;


(2)根据方框中的装置图,填写该表

(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是_____________________________________。
(4)验证CO的方法是_________________________________。
4、填空题 工业生产的纯碱常含有少量的NaCl等杂质。右图是测定产品中Na2CO3质量分数的实验装置。操作步骤有:
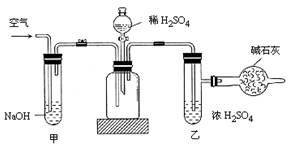
A.在干燥管内填满碱石灰,质量为mg
B.取ng样品装入广口瓶中
C.检查装置气密性
D.关闭止水夹
E.打开止水夹
F.缓慢鼓入空气数分钟,再称干燥管质量为Wg
G.缓慢加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是(填符号):
C→______→E→______→D→______→G→______→F
(2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是_________________,装置甲的作用是____________________,装置乙的作用是______________。
(3)计算溶液中Na2CO3的质量分数的计算式是_____________________。
(4)若去掉装置甲,测定结果会________,若去掉装置乙,测定结果会________。(填“偏大”、“偏小”或“无影响”)
5、实验题
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH==?________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为__________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)
①提出合理假设。
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:____________。
②设计实验方案,进行实验。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:3?mol/L?H2SO4、1?mol/L?NaOH、0.01?mol/L?KMnO4、淀粉-KI溶液、紫色石蕊试液。
