|
|
|
高中化学必备知识点《物质组成与性质实验方案的设计》试题预测(2017年最新版)(一)
2017-08-01 00:14:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (17分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验可能用到的仪器如下图所示:
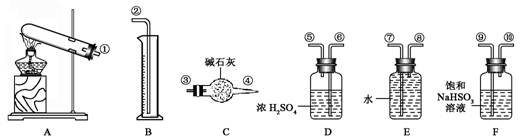
【提出猜想】
Ⅰ.所得气体的成分可能只含?一种;
Ⅱ.所得气体的成分可能含有?二种;
Ⅲ.所得气体的成分可能含有??三种。
【实验探究】
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。请回答下列问题:
(1) 请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
__?(填序号)
(2) 若实验结束,B中量筒没有收集到水,则证明猜想??正确。
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由。答:?
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
实验小组
| 称取CuSO4
的质量(g)
| 装置C增加
的质量(g)
| 量筒中水的体积折算成标
准状况下气体的体积(mL)
| 一
| 6.4
| 2.56
| 298.7
| 二
| 6.4
| 2.56
| 448
|
?
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:_____________??;
二组:_??。?
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是________和_______(填代号)。
2、实验题 (16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示:

已知:①王水是由1体积的浓硝 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
A.BaCl2
B.NaOH
C.Na2SO4
D.HCl
| (4)实验室利用下列装置和试剂制取少量氯化氢气体试剂:①浓硫酸 ②浓盐酸 ③食盐固体

若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
若选用试剂①②,则宜选择的装置是____________。
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
3、实验题 (15分)以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是___________;
(2)指出实验步骤中存在的错误并改正:___________;
(3)硫酸钠不能放置在空气中冷却的原因是___________;
(4)步骤⑤的目的是___________;
(5)下面的情况有可能造成测试结果偏高的是________________________(填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
|
E.晶体加热脱水不完全
F.加热时晶体溅出
4、实验题 (10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:
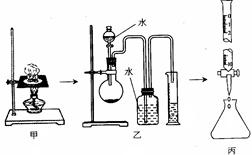
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是?。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
(2)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度___

__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
5、简答题 胆矾CuSO4?5H2O是一种蓝色晶体,用它进行以下几个实验:①取少量晶体,用研钵研碎后,放入硬质玻璃管中,加热,可以看到晶体颜色逐渐变成白色,同时试管口有水珠生成;②冷却后,取试管内少量白色粉末,用蒸馏水溶解,又得到蓝色溶液.③将此溶液分置于A、B两支试管中;④向A试管中滴入NaOH溶液后,可观察到有蓝色沉淀生成;⑤将一枚无锈铁钉放入B试管中,片刻后,取出铁钉,铁钉表面附着一层红色物质.请用化学方程式表示上述变化,并指出所发生的反应的类型.
(1)加热胆矾晶体:______,______;
(2)A试管中反应:______,______;
(3)B试管中反应:______,______.


 __(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。