| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《盐类水解的原理》在线测试(2017年最新版)(四)
参考答案:C 本题解析:A、FeC13溶液中存在FeC13的水解平衡,加热平衡正向移动,产物盐酸挥发,导致平衡右移直至水解完全,生成氢氧化铁,灼烧氢氧化铁分解生成氧化铁,错误; B、Ca(HCO3)2受热分解成碳酸钙,错误;C、Na[Al (OH)4]溶液蒸干灼烧仍能得到原物质,正确;D、Na2SO3在空气中加热会被氧气氧化为Na2SO4,错误。 本题难度:一般 4、选择题 为了除去MgCl2溶液中的Fe3+,可在加热搅拌的条件下加入的一种试剂是 |
参考答案:D
本题解析:选项A、B、C中都能引入新的杂质,不正确。氧化镁能消耗溶液中的氢离子,减弱溶液的酸性,所以可以生成氢氧化铁沉淀而除去,且不会引入杂质,答案选D。
考点:考查物质的分离和提纯。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
5、选择题 常温下,取浓度均为0.05mol·L-1的弱酸HA溶液和氨水溶液各20mL,分别用0.05mol·L-1NaOH溶液、0.05mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如下图所示,下列说法正确的是( )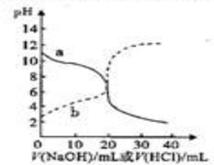
A.曲线a:滴加溶液到10mL时:c(A-)>c(Na+)>c(H+)>c(OH-)
B.曲线a:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.曲线b:滴加溶液到10mL~20mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线b:滴加溶液到20mL时:c(Na+)=c(A-)+c(HA)
参考答案:D
本题解析:本题因曲线a代表氨水,曲线b代表弱酸HA,故选项A、B、C均明显错误,根据物料守恒,D 正确。
考点: 中和滴定原理的应用
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《常见无机物.. | |