| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《盐类水解的原理》在线测试(2017年最新版)(六)
参考答案:D 本题解析:D项:等体积混合,溶液的体积扩到了二倍,浓度缩小了二倍,故C(H+)= C(A-)= C(B+)= C(OH-)=0.05mol·L-1,故错。故选D。 本题难度:困难 2、选择题 下表叙述中,评价合理的是( ) 参考答案:D 本题解析:A、H+、NO3?能氧化Fe2+,不能大量共存,错误;B、NO3?不能在酸性条件下氧化Cl?,评价错误;C、所得溶液还含有OH?,电荷守恒式应为:c(Na+)+c(H+)=c(A-)+c(Cl?)+c(OH?),错误;D、0.1mol?L?1 Na2CO3和0.1mol?L?1 NaHCO3溶液等体积混合,钠元素与碳元素对应关系为2n(Na)=3n(C),混合后存在CO32?、HCO3?和H2CO3,所以等式:3c(CO32?)+3c(HCO3?)+3c(H2CO3)=2c(Na+)成立,正确。 本题难度:困难 3、选择题 将标况下的2.24LCO2通入150mL 1mol/LNaOH溶液中,下列说法正确的是 |
参考答案:C
本题解析:标况下的2.24LCO2的物质的量为0.1mol;150mL 1mol/LNaOH溶液的物质的量为0.15mol,设反应后溶液中碳酸钠的物质的量为x,碳酸氢钠的物质的量为y;根据C元素守恒可得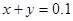 ;根据Na元素守恒可得
;根据Na元素守恒可得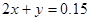 ;解得
;解得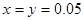 ,由于在溶液中碳酸根离子、碳酸氢根离子均要水解且碳酸根离子的水解程度大于碳酸氢根离子,所以正确选项为C;
,由于在溶液中碳酸根离子、碳酸氢根离子均要水解且碳酸根离子的水解程度大于碳酸氢根离子,所以正确选项为C;
本题难度:一般
4、选择题 下列比较不正确的是
A.等浓度的NH4HSO4、 NH3·H2O、 (NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大
B.NaClO和BaCl2混合溶液: c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-)
C.25 ℃下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol·L-1
D.常温下,将0.2 mol·L-1某一元碱ROH溶液和0.1 mol·L-1HCl溶液等体积混 合,混合后溶液pH<7,则c(ROH)>c(R+)
参考答案:C
本题解析:(NH4)2Fe(SO4)2中Fe2+与NH4+离子水解相互抑制,造成NH4+水解程度减小,浓度最大,故A项正确;C项中25 ℃下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.1 mol·L-1,故C项错误;D项常温下,将0.2 mol·L-1某一元碱ROH溶液和0.1 mol·L-1HCl溶液等体积混 合,溶液溶质为RCl与ROH混合物,均为0.05 mol·L-1,混合后溶液pH<7,说明溶液呈酸性,R+水解程度大于ROH的电离程度,c(ROH)>c(R+),故D项正确;本题选C。
考点:盐类水解、离子浓度大小比较。
本题难度:困难
5、选择题 已知草酸为二元弱酸:
H2C2O4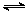 HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4-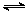 C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是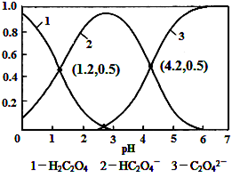
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
参考答案:C
本题解析:A、pH=1.2溶液中,电荷守恒:c(K+)+c(H+)=c(OH-)+c(HC2O4-),从图分析c(HC2O4-)=c(H2C2O4),所以有c(K+)+c(H+)=c(OH-)+c来源:91考试 网(H2C2O4),正确,不选A;B、根据电离平衡常数分析,K1=c(H+)c(HC2O4-)/c(H2C2O4)=10-1.2,K2=c(H+)c(C2O42-)/c(HC2O4-)=10-4.2,K1/K2=c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=10-1.2/10-4.2=1000,所以不选B;C、在pH=4.2时,c(C2O42-)=c(HC2O4-),溶液显酸性,说明草酸氢根的电离大于水解,所以当加入的草酸氢钾和草酸钾等物质的量加入时,电离大于水解后,二者的浓度不再相等,所以不可能配成pH=4.2的溶液,选C;D、从pH=1.2变到pH=4.2,溶液的酸性减弱,对水的电离抑制作用减弱,所以水的电离程度一直增大,不选D。
考点:溶液的酸碱性,盐类的水解,水的电离平衡
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《常见无机物.. | |