微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应:Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.在Na2FeO4中Fe为+4价,具有强氧化性.能消毒杀菌
C.3?mol?Na2O2发生反应,有12?mol电子转移
D.Na2FeO4既是氧化产物又是还原产物
参考答案:D
本题解析:分析:依据化学反应Fe2O3+3Na2O2 2Na2FeO4+Na2O,分析判断
2Na2FeO4+Na2O,分析判断
A、标注化合价升高的为还原剂,降低的为氧化剂;
B、铁元素为正六价;
C、根据氧化还原反应的电子守恒计算;
D、依据化合价的变化判断概念;
解答:A、反应中过氧化钠中 氧元素化合价选-1价降低到-2价,做氧化剂,故A错误;
B、在Na2FeO4中Fe为+6价,故B错误;
C、3?mol?Na2O2发生反应,有6?mol电子转移,故C错误;
D、Na2FeO4中的铁元素是从+3价变化来的成为+6价,氧元素化合价从-1价变化成-2价,所以Na2FeO4既是氧化产物又是还原产物,故D正确;
故选D.
点评:本题考查了氧化还原反应的应用,主要考查氧化还原反应的特征应用,概念分析,电子转移计算,氧化产物和还原产物的分析判断.
本题难度:简单
2、选择题 下列有关纯铁的描述正确的是
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓H2SO4中可钝化
参考答案:D
本题解析:试题分析:生铁是铁与碳的合金,由于合金的熔点低于组成成分中任一物质的熔点,故A不正确。生铁与盐酸反应时,铁、碳在盐酸中形成无数微小的原电池,使反应速率比纯铁要快,B不正确。同样道理,生铁在潮湿空气中,Fe、C形成原电池发生吸氧腐蚀,腐蚀速率远比纯铁要快,C不正确。金属铁、铝在常温下皆在浓硫酸、浓硝酸中发生钝化,D正确。
考点:考查铁的性质、金属的腐蚀与防护、化学反应速率
点评:该题是中等难度的试题,试题贴近高考,综合性强,注重考查学生分析问题、解决问题的能力,有助于培养学生的逻辑思维能力和发散思维能力。
本题难度:简单
3、填空题 (共4分)合成尿素的反应是分作两步进行的:
①2CO2(g)+ NH3(g) H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
②H2NCOONH4(aq) CO(NH2)2(aq)+ H2O(l) △H =-28.49kJ/mol
CO(NH2)2(aq)+ H2O(l) △H =-28.49kJ/mol
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图所示。
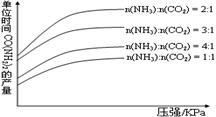
生产过程中n(NH3):n(CO2)的最佳配比为 ,而实际实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为 。在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是 。
参考答案:2:1。有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用。 加热(解释:因为生成氨基甲酸铵的反应是强烈放热反应,而第二步生成尿素的反应是一个温和的吸热反应,因此加热将有利于氨基甲酸铵的分解,但是不会显著影响氨基甲酸铵的稳定性)。
本题解析:一定压强下,单位时间内的CO(NH2)2产量越高,说明n(NH3):n(CO2)的配比最佳,由图可知,生产过程中n(NH3):n(CO2)的最佳配比为2:1;实际实际生产条件下,往往使n(NH3):n(CO2)≥3,有利于提高CO2的转化率,且NH3极易溶于水,便于分离、回收利用;生成氨基甲酸铵的反应是强烈放热反应,而第二步生成尿素的反应是一个温和的吸热反应,因此加热将有利于氨基甲酸铵的分解,但是不会显著影响氨基甲酸铵的稳定性,故用加热的方法除去尿素溶液中会含有少量的氨基甲酸铵。
考点:考查物质的分离提纯。
本题难度:一般
4、填空题 (1)在中和热测定实验中,环形玻璃搅拌棒搅拌溶液的方法是________;不能用铜丝搅拌棒代替的原因是________;实验中需要用到量筒的个数为________;反应的终止温度为________。
(2)写出NaOH稀溶液与稀硫酸反应的热化学方程式___________
参考答案:(1)上下移动;铜质搅拌棒会导热,使热量被铜棒导出,烧杯内温度降低,误差太大;2;最高温度;(2)2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H1 =-114.8kJ·mol-1
本题解析:(1)振荡混合液,一定会有部分混合液附着在内壁,这样散失的热量会使中和热测定值偏低,因此需上下移动,这样搅拌的面积大,范围广;铜质搅拌棒会导热,使热量被铜棒导出,烧杯内温度降低,误差太大,所以不能用铜丝搅拌棒代替;利用量筒量取酸、碱溶液,所以需要2个量筒;多次测量温度,取最高温度(2)根据测量数据可写出NaOH稀溶液与稀硫酸反应的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+ 2H2O(l) △H1 =-114.6kJ·mol-1
考点:考查中和热的测定。
本题难度:一般
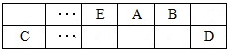
5、简答题 (15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
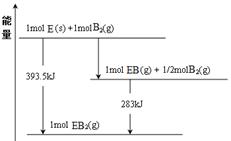
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。
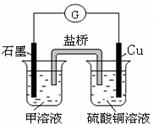
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
参考答案:(1)NH3·H2O NH4+ + OH- (2)> (3)Al(OH)3(4) ①③
NH4+ + OH- (2)> (3)Al(OH)3(4) ①③
(5)Na3N + 4H2O=3NaOH + NH3·H2O
(6)CO2(g) + C(s) =" 2CO(g)" ;△H=" +172.5kJ/mol"
或1/2CO2(g) + 1/2 C(s) =" CO(g);" △H=" +86.25kJ/mol" (7) Fe3++e-→Fe2+
本题解析:根据题意可推知:A是N;B是O;C是Na;D是Cl;E是C;F是Al;G是Fe。(1)NH3的水溶液显碱性,是因为在溶液中存在:NH3+H2O NH3·H2O; NH3·H2O
NH3·H2O; NH3·H2O NH4+ + OH-;(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b。(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾。(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O.(6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) =" 2CO(g)" ;△H= +172.5kJ/mol。(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-→Fe2+。
NH4+ + OH-;(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b。(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾。(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O.(6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) =" 2CO(g)" ;△H= +172.5kJ/mol。(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-→Fe2+。
考点:考查元素的推断、物质的性质、相互转化、影响及化学方程式、热化学方程式的书写、原电池的设计及反应原理的知识。
本题难度:困难