微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)已知一定条件下,CO(g) + H2O (g)  CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。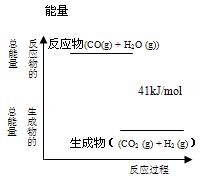
参考答案:(4分)(每空2分)
放热 CO(g) + H2O (g)  CO2(g) + H2(g) ; △H=—41kJ/mol。
CO2(g) + H2(g) ; △H=—41kJ/mol。
本题解析:略
本题难度:一般
2、选择题 下列各组中的离子,能在溶液中大量共存的是
A.H+、Na+、CO32-、Cl-
B.Ag+、Al3+、NO3-、H+
C.K+、H+、SO42-、OH-
D.Ba2+、Na+、Cl-、SO42-
参考答案:B
本题解析:分析:离子之间发生反应生成气体、弱电解质、沉淀等或发生氧化还原反应、相互促进的水解反应时,则不能大量共存.
解答:A.H+与CO32-反应生成CO2而不能大量共存,故A错误;
B.离子之间不发生任何反应,可以大量共存,故B正确;
C.H+与OH-反应生成H2O而不能大量共存,故C错误;
D.Ba2+与SO42-反应生成BaSO4沉淀而不能大量共存,故D错误.
故选B.
点评:本题考查离子共存问题,题目难度不大,注意离子的性质,做题时要注意题目中所给的隐含信息,如颜色、酸碱性等问题,为考查的主要形式和热点.
本题难度:简单
3、填空题 (2分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现已知火箭发射时可用肼(N2H4)为燃料,以NO2作氧化剂,反应生成N2(g)和气态的水,据下列的2个热化学反应方程式:
N2(g)+2O2(g)= 2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= -534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气 态水的热化学反应方程式:
态水的热化学反应方程式:

参考答案: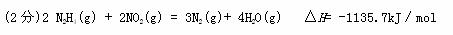
本题解析:略
本题难度:一般
4、选择题 下列化合物中,只含有共价键的化合物是( )
A.MgCl2
B.H2O
C.Na2O2
D.Ba(OH)2
参考答案:A.只含离子键,为离子化合物,故A不选;
B.只含O-H共价键,为共价化合物,故B选;
C.含离子键和共价键,为离子化合物,故C不选;
D.含离子键和共价键,为离子化合物,故D不选;
故选B.
本题解析:
本题难度:简单
5、选择题 下列离子方程式正确的是
A.双氧水与酸性KMnO4混合:MnO4-+2H2O2+3H+→Mn2++3O2↑+2H2O
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O→Fe(OH)2+2HClO
C.将1mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相混合均匀:3AlO2+9H+→Al(OH)3+2Al3++3H2O
D.双氧水从酸化海带液中提取碘:2I-+H2O2+2H+→I2+2H2O
参考答案:CD
本题解析:分析:A、离子方程式中电子不守恒;
B、次氯酸具有强氧化性能氧化亚铁离子;
C、依据偏铝酸根离子和氢离子反应生成氢氧化铝沉淀,过量氢离子溶解氢氧化铝的性质结合定量关系写出;
D、过氧化氢酸性溶液中氧化碘离子为单质碘;
解答:A、双氧水与酸性KMnO4混合反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故A错误;
B、次氯酸具有强氧化性能氧化亚铁离子?2Fe2++5ClO-+5H2O=2Fe(OH)3↓+4HClO+Cl-,;
C、将1mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相混合均匀偏铝酸根离子和氢离子反应生成氢氧化铝沉淀,过量氢离子溶解氢氧化铝的性质结合定量关系写出:3AlO2-+9H+=Al(OH)3+2Al3++3H2O,故C正确;
D、过氧化氢酸性溶液中氧化碘离子为单质碘,双氧水从酸化海带液中提取碘:2I-+H2O2+2H+=I2+2H2O,故D正确;
故选CD.
点评:本题考查了离子方程式书写方法和注意问题,注意氧化还原反应的存在和电子守恒的分析判断,题目难度中等.
本题难度:简单