| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学反应与能量》高频试题特训(2017年最新版)(六)
参考答案:B 本题解析:(①+②)×2-③,整理可得:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=(ΔH1+ΔH2)×2-ΔH3=-488.3kJ/mol,因此选项是B。 本题难度:一般 3、选择题 下列有关纯铁的描述正确的是 参考答案:D 本题解析:试题分析:生铁是铁与碳的合金,由于合金的熔点低于组成成分中任一物质的熔点,故A不正确。生铁与盐酸反应时,铁、碳在盐酸中形成无数微小的原电池,使反应速率比纯铁要快,B不正确。同样道理,生铁在潮湿空气中,Fe、C形成原电池发生吸氧腐蚀,腐蚀速率远比纯铁要快,C不正确。金属铁、铝在常温下皆在浓硫酸、浓硝酸中发生钝化,D正确。 本题难度:简单 4、选择题 下列说法正确的是 |
参考答案:B
本题解析:镁的活泼性较强,能与氮气反应,A错误;钠属于活泼金属,只能采用电解熔融的钠的化合物来制备金属钠,B正确;合成氨是可逆反应,即0.5molN2和1.5molH2充入一密闭容器中充分反应,不能生成1mol氨气,N2(g) + 3 H2(g)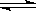 2NH3(g) 表示生成2mol氨气时放出的热量,故放出的热量大于39.2kJ,C错误;1mol氢气燃烧生成液态水时放出的热量为氢气的燃烧热,D错误,答案选B.
2NH3(g) 表示生成2mol氨气时放出的热量,故放出的热量大于39.2kJ,C错误;1mol氢气燃烧生成液态水时放出的热量为氢气的燃烧热,D错误,答案选B.
考点:热化学方程式的书写
本题难度:一般
5、填空题 (12分)(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×1 05 kJ。试写出丁烷燃烧的热化学方程式: 。已知1mol液态水汽化时需要吸收44 kJ热量,则反应C4H10(g)+6.5O2(g) ===4CO2(g)+5H2O(g)的ΔH= 。
(2)有同学用丁烷与空气为原料制作一燃烧电池,若以稀硫酸为电解质溶液时,其负极反应式为 。
(3)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为 。
参考答案:17.(1)C4H10(g)+6.5O2(g) == 4CO2(g)+5H2O (l) ΔH =-2900 kJ/mol -2680 kJ/mol
(2)C4H10-26e-+8H2O=4CO2+26H+ (3)N2(g)+3H2(g) == 2NH3(g) ΔH=-6b+c+3a kJ·mol-1
本题解析:(1)10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ,则1mol丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为2900 KJ ,则丁烷燃烧的热化学方程为C4H10(g)+6.5O2(g) == 4CO2(g)+5H2O (l) ΔH =-2900 kJ/mol, 由题意知H2O(l)=H2O(g) ΔH="44" kJ·mol-1,利用盖斯定律计算可得反应C4H10(g)+6.5O2(g) ===4CO2(g)+5H2O(g)的ΔH= -2680 kJ/mol;
(2)丁烷--空气燃料电池工作时,丁烷失电子发生氧化反应作负极;以稀硫酸为电解质溶液时,结合电极反应式的书写规律可得, C4H10-26e-+8H2O=4CO2+26H+
(3)依据△H=反应物的键能之和—生成物的键能之和可求得合成氨反应的焓变(-6b+c+3a) kJ·mol-1,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g) ==2NH3(g) ΔH=-6b+c+3a kJ·mol-1
考点:考查热化学方程式的书写,燃料电池等知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《有机合成与.. | |