微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
a
| ?
| b
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| c
| d
| ?
| ?
|
e
| f
| g
| h
| ?
| ?
| i
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| j
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)j是钴元素,试画出该元素的原子结构示意图?。
(2)c、d原子半径大小c?d,第一电离能大小关系是c?d,电负性大小关系是c?d。(以上填“>”” “<”)
(3)已知NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____?__ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____?__ (填序号) 。

(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力?②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(KJ·mol-):
?
| 锂
| X
| Y
|
失去第一个电子
| 519
| 502
| 580
|
失去第二个电子
| 7296
| 4570
| 1820
|
失去第三个电子
| 11799
| 6920
| 2750
|
失去第四个电子
| ?
| 9550
| 11600
|
表中X、Y可能分别为以上元素中的?、?(填写元素符号)元素。
参考答案:(14分)(1)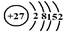 (2分)?(2)>(2分)? >(2分)? <(2分)
(2分)?(2)>(2分)? >(2分)? <(2分)
(3)b(2分)?(4)Na(2分)? Al(2分)
本题解析:考查元素周期表的结构及元素周期律的应用。
(1)根据钴元素在周期表中的位置可知,钴元素的原子序数是27,所以该元素的原子结构示意图为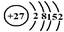 。
。
(2)c、d原子分别是N和O。由于同周期自左向右原子半径逐渐减小,所以碳原子半径大于氮原子半径。非金属性越强,第一电离能越大,氧元素的非金属性强于氮元素的,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能是氮元素大于氧元素;非金属性越强,电负性越大,所以氧元素的电负性强于氮元素的。
(3)应用氮元素的非金属性强,能和水中的氢元素形成氢键,所以形成的NH3·H2O的合理结构是b,即答案选b。
(4)X原子失去第二个电子需要的能量远高于失去第一个电子需要的能量,又因为X的第一电离能小于LI的,因此X是第IA元素,所以X是Na 。Y原子失去第四个电子需要的能量远高于失去第三个电子需要的能量,因此Y是第ⅢA元素。又因为Y的第一电离能大于钠的第一电离能,所以Y是Al。
本题难度:一般
2、填空题 (12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
下表为元素周期表的一部分,其中的字母代表相应的元素。
a
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| b
| c
| d
| ?
| ?
|
?
| e
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| f
| ?
| g
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| h
| I
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)元素h的四价阳离子的外围电子排布式为?。
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为?。(用相应元素的元素符号表示)
(3)表中所列的元素之间可以形成多种无机化合物和有机化合物,则它们形成的化合物之一——邻甲基苯甲醛的分子中碳原子轨道的杂化类型为?。
1 mol 苯甲醛分子中含有σ键的数目为?。
(4)元素d与e形成的化合物常用于制作?材料,其原因是?。
(5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为?。
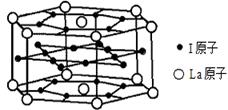
(6)元素I的合金可用来储存a的单质, 该合金的晶胞结构如图所示,则此合金的化学式为?。
参考答案:共12分。
(1)3d5(2分)?
(2)Al<Mg<O<N(2分)
(3)sp2和sp3(2分)? 14 mol或14NA(1分)
(4)耐火(1分)?晶体的晶格能较大(1分)
(5)NO2—(1分)
(6)LaNi5(2分)
本题解析:根据元素周期表可判断a~(1)根据元素周期表可判断h是Co元素,原子的外围电子的排布式为3d74s2,所以四价阳离子的外围电子排布式为3d5
(2)元素c、d、e、f分别是N、O、Mg、Al元素,N与O比,N的2p轨道是2个电子为半充满状态,所以第一电离能N>O;Mg与Al,Mg的最外层是3s轨道,有2个电子,为全充满状态,所以第一电离能Mg>Al,而电子层数越多,第一电离能越小,所以四种元素的第一电离能的大小顺序是Al<Mg<O<N;
(3)邻甲基苯甲醛的分子中苯环、醛基上的碳原子的周围有3个σ键,是sp2杂化,甲基上的碳原子周围是4个σ键,是sp3杂化;单键都是σ键,双键有1个是σ键,所以1 mol 苯甲醛分子中含有σ键的数目为14 mol或14NA;
(4)元素d与e形成的化合物是MgO,常用作耐火材料,因为MgO的晶格能较大,它的熔点高,所以被用作耐火材料;
(5)单质d3即O3,是3原子18个价电子的分子,与它互为等电子体的离子的判断,应在O元素的周围找,所以应是NO2-;
(6)元素I是Ni元素,上下底面各有6个Ni原子,侧面有 6个Ni原子,内部形成正六边形的有6个Ni原子,所以晶胞中Ni的原子个数=18×1/2+6=15;La原子位于六棱柱的顶点和上下底面的中心,所以晶胞中La原子的个数=12×1/6+2×1/2=3;所以晶胞中Ni与La的原子个数比是15:3=5:1,该晶胞的化学式为LaNi5。
本题难度:一般
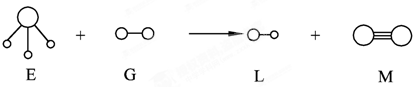
3、选择题 已知分子E和分子G反应,生成两种分子L和M(组成E、G、L、M分子的元素原子序数小于10 “○”代表原子“—”表示化学键),如下图,则下列判断错误的是(未配平)
A.G是最活泼的非金属单质
B.L中的化学键是极性键
C.E能使紫色的石蕊试液变蓝
D.M的化学性质活泼
参考答案:D
本题解析:由图,得:E为三角锥结构,故为氨分子;G、L均为双原子分子;M中两原子间形成三键,故M为氮分子;说明是氨气被氧化成氮气,所以反应为:NH3+F2→HF+N2(未配平);
F原子得电子能力最强,则元素的非金属性最强,A正确;
HF中不同原子间形成极性共价键,故B正确;
氨气溶于水生成一水合氨,能电离出OH-,显碱性,则能使紫色的石蕊试液变蓝,C正确;
氮分子中存在氮、氮三键,作用力较大,故氮分子的化学性质应比较稳定,故D错误;
本题难度:一般
4、选择题 下列物质酸性 大小比较正确的是
大小比较正确的是
A.H2SO4>CH3COOH
B.HClO3>HClO4
C.H3PO4>HNO3
D.H2CO3<HClO
参考答案:A
本题解析:略
本题难度:简单
5、填空题 四种短周期元素在周期表中的位置如图,其中只有M为金属元素。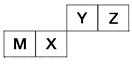
请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是________(写化学式),该氢化物的电子式为________。
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是________,列举一个化学方程式证明________________________。
(3)元素Z与元素M组成的化合物中所含化学键类型为________,元素Z与元素X组成的化合物中所含化学键类型为________。
参考答案:(1)NH3?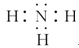
(2)H2SiO3 2HNO3+Na2SiO3=2NaNO3+H2SiO3↓
(3)离子键 共价键(或极性键)
本题解析:根据各元素的位置关系,且M是金属元素,即M是Al元素,X是Si元素、Y是N元素,Z是O元素。
本题难度:简单