微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 短周期主族元素X、Y、Z、W的原子序数依次增大,已知X、Y、Z+、W各微粒最外层电子数与其电子层数之比值依次为2、3、4、2,下列有关这四种元素叙述正确的是(?)
A.Y与X、Z、W分别能形成两种化合物
B.Z与W形成的Z2W型化合物在水溶液中Z+离子与W2-离子个数比为2:1
C.Y、Z、W不可能形成水溶液呈碱性的化合物
D.化合物X Y2、X YW、X W2随着共价键的键长逐渐增大,熔沸点逐渐降低
参考答案:A
本题解析:X、Y、Z+、W各微粒最外层电子数与其电子层数之比值依次为2、3、4、2,则短周期主族元素X、Y、Z、W分别是C、O、Na、S。A正确,化合物分别为H2O和H2O2、Na2S和Na2S2、SO3和SO2。B不正确,因为硫化钠溶于水,硫离子水解,在水溶液中Z+离子与W2-离子个数比大于2:1。C不正确,例如Na2SO3溶于水显碱性。D不正确,CO2是气体,而CS2是液体,答案选A。
本题难度:一般
2、选择题 下列有关物质性质的比较正确的为 ( )
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Cl->Br-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.①③
B.②④
C.③⑥
D.⑤⑥
参考答案:C
本题解析:可以用反例排除;①第IVA族中C的熔点最高;②中氧元素无最高正价+6;④F元素非金属性最强,但其气态氢化物水溶液是弱酸;⑤还原性:S2->Br->Cl-;故答案为C
本题难度:一般
3、选择题 下列排列顺序正确的是:
①热稳定性:H2O>HF>H2S?②原子半径:Na>Mg>O
③酸性:H3PO4>H2AsO4>H2SO4 ?④离子半径:O2->F->Mg2+
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列各组指定的元素,不能形成AB2型化合物的是( ?)
A.2s22p2和2s22p4
B.3s23p4和2s22p4
C.3s2和2s22p5
D.3s1和3s23p5
参考答案:D
本题解析:根据价电子的电子排布式可知,A中元素分别是C和O,可以形成CO2;B中分别是S和O,可以形成SO2。C中分别是Mg和F,可以形成MgF2;D中分别是Na和Cl,可以形成NaCl,所以答案选D。
点评:该题是中等难度的试题,试题侧重基础性知识的考查,兼顾能力的训练。该题的关键是准确判断出相应的元素,然后结合题干信息灵活运用即可,学生较易得分。
本题难度:一般
5、填空题 利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第三周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是________(填序号)。
a.CuSO4溶液? b.Fe2O3? c.浓硫酸? d.NaOH溶液? e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g) H2(g)+
H2(g)+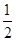 S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:____________________________________。

②电化学法
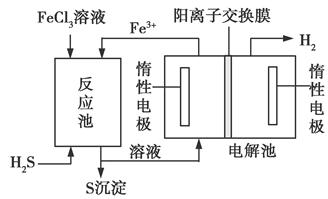
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是______________________________;
反应池中发生反应的化学方程式为____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________。
参考答案:(1)①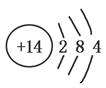 ②b、c
②b、c
(2)① 温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)
温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)
②增大反应物接触面积,使反应更充分 H2S+2FeCl3=2FeCl2+S↓+2HCl 2Fe2++2H+ 2Fe3++H2↑
2Fe3++H2↑
点拨:知识:元素推断、元素化合物性质、平衡常数、电解时离子方程式的书写。能力:读图能力、计算能力、分析问题并解决问题能力、知识的灵活运用能力。试题难度:中等。
本题解析:运用无机材料的化学式推断元素的化合价,是解决(1)小题的突破口。
①根据元素M、R均位于第三周期,且质子数之和为27,无机材料中M的化合价为+3,R的化合价为+4,可得M、R分别为Al、Si,则R的原子结构示意图为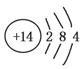 ;铝与三氧化二铁只能在高温下反应;铝与碳酸钠固体在常温下不反应;铝与硫酸铜溶液在常温下发生置换反应;常温下铝在浓硫酸中形成致密的氧化膜(钝化);铝与氢氧化钠溶液反应放出氢气。
;铝与三氧化二铁只能在高温下反应;铝与碳酸钠固体在常温下不反应;铝与硫酸铜溶液在常温下发生置换反应;常温下铝在浓硫酸中形成致密的氧化膜(钝化);铝与氢氧化钠溶液反应放出氢气。
(2)①由图知,985℃时H2S的平衡转化率为40%,则:
H2S(g) H2(g)+
H2(g)+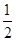 S2(g)
S2(g)
起始时浓度(mol·L-1)? c?0?0
平衡时浓度(mol·L-1)? 0.6c?0.4c?0.2c
则K=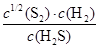 =
=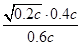 =
=
b曲线表示未达到平衡时H2S的转化率,温度越高,b曲线上的转化率越接近平衡值,原因是温度升高,反应速率加快,达到平衡所需的时间缩短。
②采用气、液逆流方式的目的是增大反应物接触面积,使反应更充分。反应池内发生反应的化学方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl。进入电解池的物质应为FeCl2和HCl,根据电解池图示,左侧生成的为Fe3+,右侧生成的为H2,则可得总反应的离子方程式:2Fe2++2H+ 2Fe3++H2↑。
2Fe3++H2↑。
本题难度:一般