微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分).A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
(1)写出三种元素名称A?、B ?、C?。
(2)B元素位于元素周期表中第?周期,?族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)?;E和Na 形成的化合物的电子式是?。
参考答案:(1)(3分)? A氮? B硫? C氟
(2)(2分)?三,ⅥA
(3)HClO4 (1分)?电子式 (2分)略
本题解析:略
本题难度:简单
2、选择题 已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是(?)
A.质子数:c>b
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径X<W
参考答案:B
本题解析:aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,说明其核外电子数是相等的,即a-3=b-1=c+2=d=1。其中W和X属于金属,位于同一周期,X位于W的左侧。Y和Z属于非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。A不正确,应是c<b。非金属性是Z大于Y,所以氢化物的稳定性是H2Y<HZ,C不正确。非金属性越强,相应阴离子的还原性就越弱,B正确。同周期自左向右原子半径逐渐减小,D不正确,应是X>W,答案选B。
本题难度:一般
3、选择题 下列排序正确的是(?)
①热稳定性:H2O>HF>H2S?②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HCl? O4?④结合H+的能力:OH—>CH3COO—>Cl—
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:非金属性越强,相应氢化物的稳定性越强,①中应是HF>H2O> H2S。同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,②正确。磷酸是弱酸,硫酸和盐酸是强酸,③不正确。酸越弱,相应的阴离子越容易结合氢离子,酸性是HCl大于醋酸,醋酸大于水的,因此④正确。所以答案是B。
本题难度:简单
4、选择题 a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是?
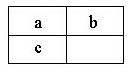
A.a与c均存在同素异形体
B.原子半径由大到小的顺序为:c > a > b
C.b的氢化物的稳定性小于 c的氢化物的稳定性
D.c的单质可用于制造太阳能电池
参考答案:C
本题解析:假设a的质子数为X,根据题意,可列出等量关系,X+X+1=X+8-1,可得X=6,依次得出a为碳元素,b为N元素,c为si元素。
A选项正确,C有常见的同素异形体有石墨,金刚石等,而硅则有多晶硅和单晶硅等。
B选项正确,周期表从左往右,原子半径依次减小,从上往下,原子半径依次增大,由这个规律可推断c > a > b。
C选项错误,氢化物稳定性随元素非金属性增强而增强,由于b的非金属性强于a,a强于c,所以b的氢化物稳定性应该大于c的氢化物,答案选C。
D选项正确,硅常用于半导体材料中。
本题难度:一般
5、选择题 38.4g铜与适量浓HNO3反应,铜全部作用后共收集到22.4L标准状况下气体(不考虑NO2转化为N2O4),则反应消耗HNO3的物质的量为?
A.1mol
B.1.6mol
C.2.2mol
D.2.4mol
参考答案:C
本题解析:38.4g铜的物质的量="0.6" mol,利用“铜”守恒,得:n[Cu(NO3)2]=" 0.6" mol;
22.4L标准状况下气体的物质的量="1" mol,成分为NO、NO2;再利用“N”守恒,得:n(HNO3)=" 0.6" mol×2+1mol=2.2mol,故选C
本题难度:简单