| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《物质结构和元素周期律》试题巩固(2017年最新版)(十)
 参考答案:图为元素周期表前四周期的一部分,由元素的位置可知,X为N,W为P,Y为S,R为Ar,Z为Br. 本题解析: 本题难度:一般 2、填空题 按构造原理写出35号元素的基态原子的电子排布式:___________,其价电子层为___________,其所在主族的价电子层为:___________,最高化合价为:___________,最低化合价为:___________。 参考答案:“略” 本题解析: 本题难度:一般 3、选择题 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( ) D.E单质中由于形成了氢键,所以很容易液化 |
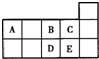
参考答案:由元素在周期表中的位置可知:A为碳元素、B为氧元素、C为氟元素、D为硫元素、E为氯元素,
A.硫在氧气中燃烧生成二氧化硫,二氧化硫在催化剂、加热条件下可以转化为三氧化硫,故A错误;
B.氢氟酸是弱酸,盐酸是强酸,盐酸的酸性更强,故B错误;
C.碳元素与氧元素可以组成CO32-、C2O42-,故C正确;
D.氯气分子中不存在氢键,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 下列关于周期表中主族元素性质的叙述中不正确的是
[? ]
A.主族序数等于原子最外层电子数
B.主族元素最高正价等于最外层电子数
C.第n主族元素其最高正价为+n价,负价绝对值为8-n(n≥4)
D.第n主族元素其最高价氧化物分子式为R2On,氢化物分子式为RHn(n≥4)
参考答案:D
本题解析:
本题难度:简单
5、填空题 A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置:______周期______族;化合物M中含有的化学键类型有_____________;用电子式表示化合物A2C的形成过程:_________________________
(2)比较B、C、E形成的气态氢化物的稳定性(用化学式表示):________>________>__________;写出C与A形成的18e-化合物的电子式_________________________;
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式: _________________________;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为__________________________。
参考答案:(1)三;ⅣA;离子键、共价键;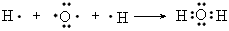
(2)H2O;NH3;SiH4;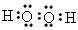
(3)SiO2+2OH-==SiO32-+H2O
(4)H2-2e-+2OH-==2H2O
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《醇》高频试.. | |