微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
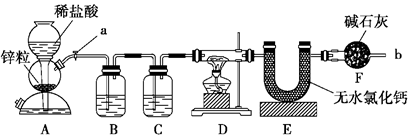
(1)如何检查装置A的气密性?
?_
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,其目的是?,
其原理是?。
(3)为了安全,在点燃D处的酒精灯之前,在b出口处必须?。
(4)装置B的作用是?;
装置C中装的液体是?,所起的作用是?。
(5)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是?。
(6)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U型管的质量增加7.2 g,则混合物中Fe2O3的质量为?g。
(7)U形管E右边又连接干燥管F的目的是?,若无干燥管F,测得Fe2O3的质量将?(填“偏大”、“偏小”或“无影响”)。
(8)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将?(填“偏大”、“偏小”或“无影响”)。
2、填空题 (6分)今有Fe和Zn的混合物12.1g,与足量的稀盐酸反应,共放出H2 4.48L(标准状况)。求:
(1)原混合物中Fe的质量分数。
(2)消耗HCl的物质的量。
3、实验题 绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:
25℃时
| pH值
|
饱和H2S溶液
| 3.9
|
SnS沉淀完全
| 1.6
|
FeS开始沉淀
| 3.0
|
FeS沉淀完全
| 5.5
|
?
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为?。
A.KSCN溶液? B.NaOH溶液? C.KMnO4溶液? D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是?;在溶液中用硫酸酸化至pH=2的目的是?。
(3)操作IV的顺序依次为?、冷却结晶、?。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②?。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为?(填仪器名称)。
②判断此滴定实验达到终点的方法是?。
③计算上述样品中FeSO4·7H2O的质量分数为?。
4、选择题 氧化铁和氧化铜混合物mg,加3mol·L-1盐酸溶液100mL,恰好完全溶解,若mg的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为(?)
A.(m-2.4)g
B.(m-1.6) g
C.(m-3.2)g
D.无法确定
5、填空题 现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,
以下是以硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁α?Fe2O3)的生产流程示意图:
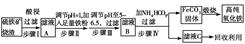
(1)步骤Ⅰ中过滤所得滤渣的主要成分是________。
(2)步骤Ⅱ中加入铁粉的目的是________。
(3)步骤Ⅲ中可选用________调节溶液的pH。
A.稀硝酸
B.双氧水
C.氨水
D.高锰酸钾溶液