?
参考答案:(共8分)(每空1分)
?
试剂
离子反应方程式
①
CO2
CO2-3?+CO2+H2O ===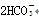
②
NaOH溶液
Al2O3+2OH-══ 2AlO-2+H2O
③
Cl2
2Fe2++ Cl2=2Fe3++ 2Cl-
④
饱和的NaHCO3溶液
HCO-3+H+= CO2↑+ H2O
本题解析:
?
试剂
离子反应方程式
①
CO2
CO2-3?+CO2+H2O ===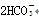
②
NaOH溶液
Al2O3+2OH-══ 2AlO-2+H2O
③
Cl2
2Fe2++ Cl2=2Fe3++ 2Cl-
④
饱和的NaHCO3溶液
HCO-3+H+= CO2↑+ H2O
考点:
点评:离子方程式是书写基本步骤:
1.写
明确写出有关反应的化学方程式。
2.拆
①可溶性的强电解质(强酸、强碱、可溶性盐)一律用离子符号表示,其它难溶的物质.难电离的物质、气体、氧化物,水等仍用化学式表示。
②对于微溶物质来说在离子反应中通常以离子形式存在(溶液中),但是如果是在浊液里则需要写出完整的化学式,例如,石灰水中的氢氧化钙写离子符号,石灰乳中的氢氧化钙用化学式表示。浓硫酸中由于存在的主要是硫酸分子,也书写化学式。浓硝酸、盐酸是完全电离的,所以写离子式。
3.删
删去方程式两边相同的离子和分子。
4.查
检查式子两边的各种原子的个数及电荷数是否相等,是否配平,还要看所得式子化学计量数是不是最简整数比,若不是,要化成最简整数比。
只要熟练掌握化学方程式的书写,此题便不难解决。
本题难度:一般
2、选择题 下列反应的离子方程式正确的是BD
A.氨气通入盐酸溶液 HCl+NH3 ="=" NH4Cl
B.澄清的石灰水跟盐酸反应 H++OH- ="=" H2O
C.碳酸钡溶于醋酸 BaCO3+2H+ ="=" Ba2++H2O+CO2↑
D.金属钠跟水反应 Na+2H2O ="=" Na++2OH-+H2↑
参考答案:B
本题解析:氯化铵用离子表示,A不正确。醋酸是弱酸,用化学式表示。D中电子得失不守恒,所以正确的答案选B。
本题难度:简单
3、实验题 (16分)铁是人类较早使用的金属之一。运用铁的有关知识,回答下列问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的 微粒大小范围是?nm 微粒大小范围是?nm
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3 溶液与铜反应的离子方程式 溶液与铜反应的离子方程式
? ?。 ?。
检验反应后的溶液中还存在Fe3+的试剂是?
(3)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①蒸馏水
②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水⑦氯气,需要用到的试剂是?(填序号)
整个实验过程中涉及到的离子方程式
?
?、
?
??、??、
?、
参考答案:(16分)?(1)1—100(2分)
(2) 2 Fe3++ Cu = 2Fe2++ Cu2+ (2分)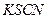 溶液(2分,用NaOH溶液也给分) 溶液(2分,用NaOH溶液也给分)
(3) ①②④⑦(2分)? 2 Fe3+ + Fe=" 3" Fe2+ (2分)Fe  + Cu2+= Fe2++ Cu (2分) Fe + 2H+= Fe2++ H2(2分) 2Fe2++ Cl2=2Cl-+2Fe3+(2分) + Cu2+= Fe2++ Cu (2分) Fe + 2H+= Fe2++ H2(2分) 2Fe2++ Cl2=2Cl-+2Fe3+(2分)
本题解析:略
本题难度:简单
4、选择题 下列离子方程式正确的是( )
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32—+4H+=SO32—+3S↓+2H2O
参考答案:B
本题解析:从反应事实和三守恒(质量守恒、电子守恒、电荷守恒)角度入手分析解决问题。
A.HClO为弱酸,部分发生电离,在离子方程式中不能拆分成离子形式。B.H2O2具有强氧化性,KI具有强还原性,两者能发生氧化还原反应。C.铜为活性电极,用铜作电极电解硫酸铜溶液,构成电镀池,阳极为电极本身失电子被氧化,不能生成O2,选项中的离子方程式表示的是惰性电极电解硫酸铜溶液。D.不符合反应事实,硫代硫酸钠溶液中加入稀硫酸后除生成硫酸钠、单质硫外还有SO2,离子方程式应为S2O32—+2H+=SO2↑+S↓+H2O。
点拨:知识:弱电解质电离、氧化还原反应、电解方程式。能力:应用所学知识分析解决问题的能力。试题难度:中等。
本题难度:一般
5、选择题 下列反应的离子方程式书写正确的是
[? ]
A.?二氧化碳与氢氧化钠溶液反应:CO2+OH-=CO32- +H2O
B.?铁与稀硫酸反应;Fe+2H+=Fe3+ +H2
C.?稀硫酸加入到氢氧化钡溶液中:H++OH-=H2O
D.?氯气通入溴化钾溶液中:Cl2+2Br-=Br2+2Cl-
参考答案:D
本题解析:
本题难度:简单
|