微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图,在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
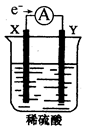
A.Y 极上产生无色无味气泡
B.若两电极分别为 Fe 和碳棒,则 X 为碳棒, Y 为 Fe
C.X 极上发生的是还原反应, Y 极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为 X > Y
参考答案:AD
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据电子的流向可判断,X是负极,Y是正极,溶液中的氢离子在正极得到电子,生成氢气。所以选项AD正确,BC是错误的,答案选AD。
本题难度:一般
2、选择题 已知Na2S2O3+H2SO4═Na2SO4+SO2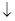 +SO2
+SO2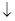 +H2O下列各组实验中溶液最先变浑浊的是?
+H2O下列各组实验中溶液最先变浑浊的是?
组号
| ?
| 参加反应的物质
|
反应温度(℃)
| 
| 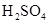
| 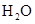
|
V(mL)
| C(mol/L)
| V(mL)
| C(mol/L)
| V(mL)
|
A
| 10
| 5
| 0.1
| 5
| 0.1
| 5
|
B
| 10
| 5
| 0.1
| 5
| 0.1
| 10
|
C
| 30
| 5
| 0.2
| 5
| 0.2
| 5
|
D
| 30
| 5
| 0.2
| 5
| 0.2
| 10
参考答案:C
本题解析:影响反应速率的因素中,影响由大到小为催化剂、温度、浓度和压强;故排除AB。浓度为混合后的浓度,C中总体积下,浓度大。故C速率最大。
本题难度:简单
3、简答题 现有如下两个反应:(A)NaOH+HCl=NaCl+H2O? (B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池______
(2)如果不能,说明其原因______
(3)如果可以,请写出正负极材料名称和电极反应式.
______是正极,正极反应式:______
______是负极,负极反应式:______.
参考答案:(1)原电池是将化学能转变为电能的装置,只有氧化还原反应才有电子的转移,而(A)为非氧化还原反应,不能设计成原电池,(B)为氧化还原反应,可以设计成原电池,
故答案为:(A)不行(B)可以;
(2)原电池是将化学能转变为电能的装置,正极发生还原反应,负极发生氧化反应,A)为非氧化还原反应,没有发生电子的转移,故不能设计成原电池,
故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)在2FeCl3+Cu=2FeCl2+CuCl2反应中,FeCl3被还原,为正极反应,可用碳棒作正极,电极反应为2Fe3++2e-=2Fe2+,
Cu被氧化,为原电池负极反应,电极反应为Cu-2e-=Cu2+,
故答案为:碳棒;2Fe3++2e-=2Fe2+;铜片;Cu-2e-=Cu2+.
本题解析:
本题难度:一般
4、选择题 根据下列事实,判断离子的氧化性顺序为①A+B2+=A2++B②D+2H2O=D(OH)2+H2↑③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+( )
A.E2+>B2+>A2+>D2+
B.D2+>E2+>A2+>B2+
C.D2+>A2+>B2+>E2+
D.A2+>B2+>D2+>E2+
来源:91考试网 91eXAm.org
参考答案:①A+B2+=A2++B中,氧化性B2+>A2+,
②D+2H2O=D(OH)2+H2↑中,氧化性H+>D2+,
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+,氧化性E2+>B2+,
所以这几种离子的氧化性大小顺序为:E2+>B2+>A2+>D2+,
故选A.
本题解析:
本题难度:简单
5、选择题 有关如右图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,不正确的是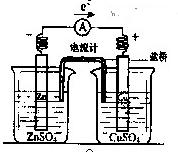
A.铜片上有红色物质附着
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.锌片上发生氧化反应
参考答案:B
本题解析:原电池中,溶液中的阳离子在正极得电子,被还原。A正确;盐桥中的K+会移向CuSO4溶液,补充阳离子。C正确;锌片是负极,被氧化,D正确;B取出盐桥后,正负极断开,不构成原电池。
本题难度:一般
|