| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《氧化还原反应的基本概念》高频考点特训(2017年练习版)(二)
F.MnO2 + 4HCl(浓) 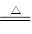 ?MnCl2 + Cl2↑+ 2H2O ?MnCl2 + Cl2↑+ 2H2O(2)根据反应Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,回答下列问题: ①还原剂是________,还原产物是________。 ②被还原的硝酸与未被还原的硝酸的物质的量比是________。 ③用单线桥表示此反应转移的电子数目及方向。 参考答案:(1)①D ②A ③B ④E ⑤F 本题解析:略 本题难度:简单 2、填空题 印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下: Cu + 2 FeCl3 === CuCl2 + 2 FeCl2 参考答案:(1)“略” 本题解析: 本题难度:一般 3、选择题 取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是(?) 参考答案:B 本题解析: 本题难度:简单 4、填空题 (1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为_____________。 参考答案:(1) 本题解析:(1)HCl失去10电子给KMO4,且KMnO4作氧化剂,氧化性大于HCl。氧化产物是Cl?2,还原产物是MnCl2。(2)利用电子得失相等和原子个数守恒,可以配平。(3)反应了6.8g的NH3,,实际发生氧化反应的0.1mol NH3,应转移0.3 NA个电子。 本题难度:一般 5、选择题 根据反应:2H2S+O2=2S↓+2H2O,4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,Na2S+I2=2NaI+S↓,下列物质的氧化性强弱判断正确的是 参考答案:A 本题解析:考查氧化性强弱顺序的判定 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《未知》高频.. | |