微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.离子化合物中阴阳离子间只有静电引力
B.在共价化合物中不可能含有离子键
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物不一定是离子化合物
参考答案:A、因离子键是阴阳离子间的静电作用形成的,则在离子化合物中阴阳离子间有静电引力和斥力,故A错误;
B、因含离子键的化合物一定为离子化合物,则共价化合物中一定不含有离子键,故B正确;
C、含有共价键的化合物中也可能含有离子键,如NaOH,故C错误;
D、含有离子键的化合物一定是离子化合物,故D错误;
故选B.
本题解析:
本题难度:简单
2、选择题 有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+等微粒,对该酸性溶液分别进行实验:(1)加热,放出的气体可以使品红溶液褪色;(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸.
对于下列微粒不能确认其在原溶液中是否存在的是
A.SO42-
B.Br-
C.H2SO3
D.NH4+
参考答案:A
本题解析:分析:二氧化硫气体可以使品红溶液褪色,氨气能使湿润的红色石蕊试纸变蓝,硫酸钡是不溶于硝酸的白色沉淀,据此来回答问题.
解答:(1)加热,放出的气体可以使品红溶液褪色,证明其中含有H2SO3;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝,证明含有铵根离子;
(3)取原溶液加氯水,溶液略显黄色,则含有溴离子,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,证明含有硫酸根,但是在亚硫酸存在的前提下,亚硫酸也会被硝酸氧化为硫酸,所以不能确认硫酸根在原溶液中是否存在.
故选A.
点评:本题考查常见阴离子的检验,要掌握常见阴离子的检验方法,并会设计合理的实验.
本题难度:简单
3、选择题 由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH怎样变化?
A.不变
B.先变小后变大
C.逐渐变大
D.逐渐变小
参考答案:C
本题解析:试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,氢离子在正极得到电子,生成氢气而逸出,所以溶液中氢离子的难点降低,则pH逐渐增大,答案选C。
考点:考查题型原电池的有关判断、pH的计算
点评:该题是基础性试题的考查,属于常规性试题,难度不大。学生记住原理即可,该题有利于培养学生的学习自信心。
本题难度:困难
4、选择题 下列哪一组溶液的反应可用H++OH-═H2O表示
A.硫酸和氢氧化钡
B.硫酸和氢氧化铜
C.硫酸氢钠和烧碱
D.硫酸和氨水
参考答案:C
本题解析:分析:强酸与强碱生成可溶性盐和水的离子反应可用H++OH-═H2O表示,以此来解答.
解答:A.硫酸和氢氧化钡反应生成硫酸钡,硫酸钡不溶于水,则不能用H++OH-═H2O表示,故A不选;
B.硫酸和氢氧化铜生成硫酸铜和水,氢氧化铜不溶于水,则不能用H++OH-═H2O表示,故B不选;
C.硫酸氢钠和烧碱反应生成可溶性硫酸钠和水,能用H++OH-═H2O表示,故C选;
D.硫酸和氨水反应生成硫酸铵和水,一水合氨为弱电解质,应保留化学式,则不能用H++OH-═H2O表示,故D不选;
故选C.
点评:本题考查离子方程式书写的正误判断,明确发生的化学反应及离子方程式的书写方法即可解答,难度不大.
本题难度:困难
5、填空题 (13分) 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
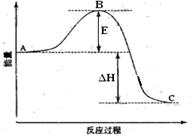
 (1)图中A、C分别表示 、
(1)图中A、C分别表示 、
(2) E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
 (3)图中△H= KJ·mol-1;
(3)图中△H= KJ·mol-1;
 (4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
参考答案:(1)反应物能量 生成物能量
(2)无 降低 因为催化剂改变了反应的历程使活化能E降低
(3)-198
(4)SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5 0.025 0.05
(5)-1185kJmol-1
本题解析: (1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(2)图中表示来源:91考试网 www.91exAm.org的是2molSO2的反应,因此△H=-99×2KJ·mol-1;
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5;
(4)依据速率之比等于化学计量数之比计算即可。
(5)根据题意①S(s)+O2(g) =SO2(g) △H= —296KJ/mol,又因为②SO2(g)+1/2O2(g) =SO3(g) △H= —99kJ/mol。根据盖斯定律可知①+②即得到S(s)+3/2O2(g) =SO3(g) △H= —395KJ/mol,所以由S(s)生成3 molSO3(g)的△H=—395KJ/mol×3=-1185kJmol-1。
本题难度:一般