微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应既属氧化还原反应,又属放热反应的是(? )
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应
D.甲烷在氧气中的燃烧反应
参考答案:AD
本题解析:A、C、D属氧化还原反应,B为复分解反应属非氧化还原反应,A、D属放热反应,而灼热碳与二氧化碳的反应是吸热反应。
本题难度:一般
2、计算题 (10分)实验测得每1 g碳充分燃烧生成CO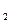 气体放出32.79 kJ的热量。试计算2 kg碳充分燃烧生成CO
气体放出32.79 kJ的热量。试计算2 kg碳充分燃烧生成CO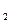 气体时放出多少热量。
气体时放出多少热量。
参考答案:6.56×104 kJ
本题解析:化学变化往往伴随着能量的变化,碳燃烧的方程式可表示为C+O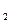
 CO
CO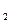 。因生成的热量与反应物的质量成正比,所以2 000 g碳完全燃烧放出的热量是1 g碳完全燃烧时的2 000倍。2×10
。因生成的热量与反应物的质量成正比,所以2 000 g碳完全燃烧放出的热量是1 g碳完全燃烧时的2 000倍。2×10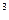 ×32.79 kJ=6.56×10
×32.79 kJ=6.56×10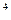 kJ。
kJ。
本题难度:一般
3、选择题 已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量 ②1molCl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。 下列叙述正确的是
[? ]
A.氢气与氯气反应生成2mol氯化氢气体,需要释放183kJ的热量
B.氢气与氯气反应生成2mol氯化氢气体,需要吸收183kJ的热量
C.氢气与氯气反应生成1mol氯化氢气体,需要吸收183kJ的热量
D.氢气与氯气反应生成1mol氯化氢气体,需要释放183kJ的热量
参考答案:A
本题解析:
本题难度:一般
4、填空题 X、Y、Z、W均为10电子的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:
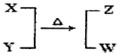
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式: 。
(2)工业制取Z的化学平衡常数K与T的关系如下表:
T/K
| 298
| 398
| 498
| ……
|
K/(mol·L—1)—2
| 4.1×106
| K1
| K2
| ……
|
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
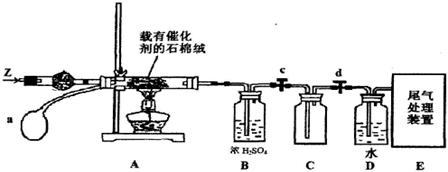
①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(4)写出D装置中反应的化学方程式 。
(5)a中通入空气的作用 。
参考答案:(1)N2(g)+3H2 2NH3(g) ΔH=—92.4KJ/mol(3分)
2NH3(g) ΔH=—92.4KJ/mol(3分)
(2) ① > ②CD
(3)①4NH+5O2 4NO+6H2O ②吸收水和多余的氨气
4NO+6H2O ②吸收水和多余的氨气
(4)3 NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3
(5)氧化NH3和NO
本题解析:(1)5个原子核的10电子的微粒一般为CH4、NH4+NH4+,W为无色液体,10电子的无色液体为H2O,所以猜想该反应为NH4+与OH-制取NH3的反应,X为NH4+,Y为OH-,Z为NH3。工业制取氨气的化学反应为N2+3H2 2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2
2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2 2NH3(g) ΔH=—92.4KJ/mol
2NH3(g) ΔH=—92.4KJ/mol
(2)①制取氨气的反应为放热反应,升高温度有利于平衡逆向移动,平衡常数减小,所以K1>K2
②A、达平衡时容器内各物质的浓度之比不一定为化学计量数比,错误;B、恒容的容器中,气体的密度始终不变,错误;C、随着反应的进行,气体的压强逐渐减小,达平衡时不再变化,正确;D、随着反应的进行,气体的物质的量逐渐减小,气体的相对分子质量逐渐增大,达平衡时不再变化,正确,答案选CD。
(3)①A中发生反应是氨气的催化氧化,其化学方程式是4NH+5O2 4NO+6H2O
4NO+6H2O
②浓H2SO4具有吸水性,也可以和氨气反应,所以B中浓H2SO4的作用是吸收水和多余的氨气
(4)由于空气的不断鼓入,二氧化氮与水、氧气完全反应生成硝酸,化学方程式为4NO2+O2+2H2O=4HNO3或3 NO2+H2O=2HNO3+NO
(5)a中通入空气的作用就是不断氧化NH3和NO
考点:考查10电子微粒的推断,氨气的合成,硝酸的制取,化学平衡常数的比较,平衡状态的判断,化学方程式的书写
本题难度:困难
5、选择题 已知:
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1) △H1
H2O(1)=H2O(g) △H2
C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) △H3
则
参考答案:
本题解析:
本题难度:一般