|
高考化学知识点总结《化学平衡》试题预测(2017年最新版)(六)
2017-08-01 00:46:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器中充入一定量的NO2,发生反应2NO2(g) 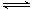 N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( ) N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
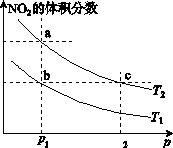
A.a、c两点的反应速率:a>c
B.a、b两点NO2的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
|
参考答案:B
本题解析:A、由图象可知,a、c两点都在等温线上,c的压强大,则a、c两点的反应速率:a<c,故A错误;B、a、b两点压强相同,但温度不同,a点二氧化氮的体积分数较大,说明a点的转化率较小,即a<b,故B正确;C、NO2为红棕色气体,由图象可知,a、c两点都在等温线上,c的压强大,增大压强,容器的体积减小,c点时NO2的浓度大,混合气体颜色深,故C错误;D、升高温度,化学平衡向着逆向移动,NO2的体积分数减小,a点到b点二氧化氮体积分数减少,说明是降低了温度,所以不能用加热的方法实现由a点到b点的转变,故D错误。
考点:本题考查化学平衡移动、图像的分析。
本题难度:困难
2、选择题 下列说法正确的是
[? ]
A.把NaHCO3和Na2CO3混和物6.85 g溶于水制成100 mL溶液,其中c(Na+)=1 mol·L-1. 该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B.将54.4 g铁粉和氧化铁的混合物中加入4.0mol/L200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生, 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42+ 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+
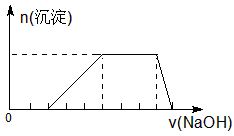
参考答案:B
本题解析:
本题难度:一般
3、实验题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
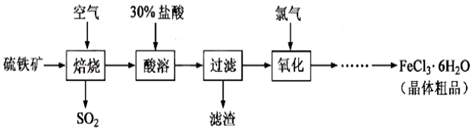
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
参考答案:(1) SO2+NaOH=NaHSO3; SO2+NaOH=NaHSO3;
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+ Cl2 HCl
本题解析:(1)根据化学平衡常数概念写出平衡常数表达式;在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为 2SO3(g) ,该反应的平衡常数表达式为 ;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。 ;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。
考点:以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程为载体考查平衡常数表达式的书写、物质的分离和提纯。
本题难度:困难
4、选择题 已知常温下反应①、②、③的平衡常数关系为K1> K3> K2,据此所做以下推测合理的是
①NH3+H+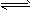 NH4+ (平衡常数为K1)②Ag++Cl- NH4+ (平衡常数为K1)②Ag++Cl-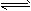 AgCl(平衡常数为K2) AgCl(平衡常数为K2)
③Ag++2NH3 Ag(NH3)2+(平衡常数为K3) Ag(NH3)2+(平衡常数为K3)
[? ]
A.氯化银可溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸无明显现象
D.银氨溶液可在酸性条件下稳定存在
参考答案:A
本题解析:
本题难度:一般
5、选择题 对于一可逆反应,当确知平衡向正反应方向移动,下列说法肯定正确的是( )
A.反应物的转化率将提高
B.生成物的产量将增加
C.生成物的浓度将增大
D.生成物的百分含量将增大
参考答案:A.增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故A错误;
B.平衡向正反应方向移动,生成物的产量一定增加,故B正确;
C.如在一定压强的密闭容器中,正反应是气体体积增大的反应,向容器中通入稀有气体,平衡向正反应方向移动,但生成物浓度降低,故C错误;
D.如增加反应物的物质的量,平衡向正方向移动,若增加的多,转化的少,则生成物的百分含量反而减小,故D错误;
故选B.
本题解析:
本题难度:简单
|