|
高考化学知识点总结《化学平衡》试题预测(2017年最新版)(四)
2017-08-01 00:46:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲、乙、丙三个容器中最初存在的物质的量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2 与丙中N2O4 的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
| 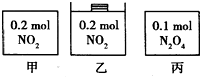
参考答案:甲、乙存在平衡2NO2?N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,乙中到达的平衡相当于在甲平衡的基础上增大压强,丙中存在平衡N2O4?2NO2,相当于开始加入2molNO2,与甲为等效平衡,
A.甲与丙为完全等效平衡,平衡时NO2浓度的相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,但平衡移动的结果是降低NO2浓度增大,不会消除增大,故平衡时容器内c(NO2)的大小顺序为乙>甲=丙,故A错误;
B.甲与丙为完全等效平衡,平衡时N2O4的百分含量相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,平衡时N2O4的百分含量增大,故平衡时N2O4的百分含量:乙>甲=丙,故B正确;
C.甲与丙为完全等效平衡,平衡时甲、丙中N2O4的物质的量相等,则0.2α=0.1(1-α),解得α=13,故平衡时甲中NO2 与丙中N2O4 的转化率可能相同,故C错误;
D.甲与丙为完全等效平衡,平衡时混合气体的平衡摩尔质量相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,总的物质的量减小,乙中平均摩尔质量解得,故平衡时混合物的平均相对分子质量:乙>甲=丙,故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 右图表示可逆反应mA(g) + nB(g)  ?pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是? ?pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是?

A.吸热反应,m+n<p?
B.吸热反应,m+n>p
C.放热反应,m+n<p?
D.放热反应,m+n>p
参考答案:D
本题解析:分析图(1),P1比P2先达平衡,说明P1>P2,压强增大,生成物C的物质的量分数增大,说明正反应是气体体积缩小的反应;再分析图(2),T2比T1先达平衡,说明T2> T1,温度降低,生成物C的物质的量分数增大,说明正反应是放热反应。
本题难度:简单
3、填空题 (16分)某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果。
已知:C(s)+O2(g) 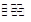 CO2(g) △H=-393kJ?mol-1; CO2(g) △H=-393kJ?mol-1;
2CO (g)+O2(g) 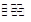 2CO2(g) △H=-566kJ?mol-1; 2CO2(g) △H=-566kJ?mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为 。
(2))将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)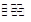 CO2(g)+H2(g),得到如下三组数据: CO2(g)+H2(g),得到如下三组数据:
实验组序
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
| H2O
| CO
| CO2
| 1
| 500
| 4
| 8
| 3.2
| 4
| 2
| 750
| 2
| 4
| 0.8
| 3
| 3
| 750
| 2
| 4
| 0.8
| 1
|
①该反应的正反应为 (填“吸热”或“放热”)反应。
②实验1中,0~4min时段内,以v(H2)表示的反应速率 为 。
③实验2达到平衡时CO的转化率为 。
④实验3与实验2相比,改变的条件是 ;
请在下图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注。
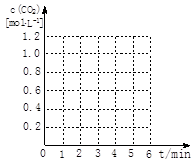
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为 。
参考答案:(1)(2分)C(s)+H2O(g)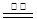 CO(g)+H2(g) △H=+132kJ?mol-1 CO(g)+H2(g) △H=+132kJ?mol-1
(2)①放热(2分) ②0.8mol/(L·min) (2分)
③20%((2分) ④加催化剂(2分) [画曲线见右图] 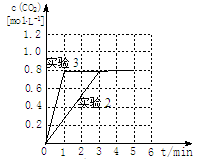 (2分) (2分)
(3)(2分)4OH--4e-=O2↑+2H2O
(4)(2分)CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3
本题解析:(1)已知:①C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g) CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g) 2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g)  CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min) 91ExAM.org;③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。 CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min) 91ExAM.org;③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
考点:考查热化学方程式书写、盖斯定律,化学反应速率和化学平衡,电极反应式、化学方程式的书写。
本题难度:困难
4、填空题 【化学——选修2:化学与技术】(15分))
(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______ ________(填序号)
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得:
SiO2 + C + N2 = Si3N4 + CO)
①配平上述反应的化学方程式
②该反应的平衡常数表达式为K= 。
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 _ _ (填两种物质名称),其净水作用的原理是 .
参考答案:(1)③①②;(2)否;否;(3)?3、6、2、1、6;?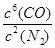 ;(4)明矾、硫酸铝、硫酸铁、 硫酸亚铁(填其中任何两种);铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中其他带异电的胶体,使其聚沉,达到净化目的。 ;(4)明矾、硫酸铝、硫酸铁、 硫酸亚铁(填其中任何两种);铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中其他带异电的胶体,使其聚沉,达到净化目的。
本题解析:
试题解析:(1)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、人e3+等,过滤后加入盐酸可除去Na2CO3,(2)催化剂只对反应速率有影响,催化剂不影响化学平衡,所以变化对二氧化硫的转化率产生影响,也不会影响反应放出的热量,(3)①由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2+6C+2N2  Si3N4+6CO.②固体和纯液体的浓度不变,故该反应的平衡常数表达式为:K= Si3N4+6CO.②固体和纯液体的浓度不变,故该反应的平衡常数表达式为:K=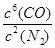 ;(4)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾、硫酸铝、硫酸铁、硫酸亚铁等。 ;(4)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾、硫酸铝、硫酸铁、硫酸亚铁等。
考点:化学实验操作的先后顺序;氧化还原反应方程式的配平;化学平衡的影响因素
本题难度:一般
5、选择题 恒容密闭容器中,发生反应H2(g)+Br2(g)  2HBr(g) ΔH<0。恒温下发生反应,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( ) 2HBr(g) ΔH<0。恒温下发生反应,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b
B.a=b
C.a<b
D.无法确定
| 
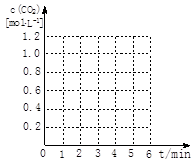
 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。