微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍。下列说法不正确的是
A.原子半径大小顺序:Z>W>R
B.对应的氢化物的热稳定性:R>W
C.W与X、W与Z形成的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
参考答案:C
本题解析:根据X、Y、Z、W、R是原子序数依次增大的短周期主族元素知,X是周期表中原子半径最小的元素,X为H,Y元素的最高价与最低负价绝对值相等,Y为C(Y如果为Si,则Z不属于短周期元素),Z的核电荷数是Y的2倍,Z为Mg,W最外层电子数是最内层电子数的3倍,W为S,R为Cl。W与X形成的化合物是H2S,共价化合物,W与Z形成的化合物是MgS,离子化合物,所以化学键类型不同。答案选C。
考点:物质结构元素周期律
点评:这类习题是高考的热点考题,解决这类习题的关键是要准确推断出各元素,然后根据“位—构—性”进行判断对错。
本题难度:一般
2、选择题 某短周期元素M可用于制造绚丽多彩的焰火,该元素的一个原子可失去2个电子,这2个电子转移到Y元素的2个原子中可形成化合物Z。判断下列说法中,正确的是
A.Z属于共价化合物
B.Z可表示为M2Y
C.元素M的最外层电子数多于4个
D.M形成+2价阳离子
参考答案:D
本题解析:由题意知,一个M原子失去2个电子形成M2+,且属于短周期,故M的最外层电子数应为2个。一个Y原子得到1个电子形成Y+,故Z属于离子化合物,化学式为MY2。
本题难度:一般
3、选择题 在实验室里不宜长期放置,应该现用现配的溶液是
①碘酒溶液,
②硫酸亚铁溶液,
③碳酸氢钠溶液,
④氯水,
⑤酸化的三氯化铁溶液,
⑥硫化氢溶液
A.只有②④外
B.除①以外
C.只有②④⑥
D.全部
参考答案:C
本题解析:
本题难度:困难
4、选择题 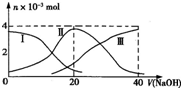 常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表
常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表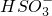 、Ⅲ代表
、Ⅲ代表 ).根据图示下列判断正确的是
).根据图示下列判断正确的是
A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-12?
B.当V(NaOH)=20?mL时:c(Na+)>c()>c(H+)>c()>c(OH-)
C.当V(NaOH)=40?mL时2c(Na+)=c()
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,溶液的温度会继续升高
参考答案:B
本题解析:分析:A.当V(NaOH)=0时,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=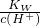 ;
;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,电离为主,溶液显酸性;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应.
解答:A.当V(NaOH)=0时,由图象可知,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=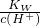 ≠1.0×10-12mol/L,故A错误;
≠1.0×10-12mol/L,故A错误;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,HSO3-电离大于水解,溶液显酸性,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故B正确;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主,则c(Na+)>2c(SO32-),故C错误;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应,所以温度变化不明显,不会继续升高,故D错误;
故选B.
点评:本题考查离子反应,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图中分析即可,不需要进行计算,题目难度中等.
本题难度:困难
5、选择题 纳米泡沫碳是一种固体单质碳,外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同一种物质
B.同分异构体
C.同系物
D.同素异形体
参考答案:D
本题解析:
本题难度:一般