| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《化学反应速率》考点特训(2017年冲刺版)(六)
参考答案:D 本题解析:①增大压强,可增大单位体积的活化分子数,加快反应速率,但没有增大活化分子百分数,不选①;②升温可以增大活化分子百分数,加快反应速率,选②;③增大氧气的浓度,可增大单位体积内活化分子数,加快反应速率,但不能增大活化分子百分数,不选③;④使用催化剂,可以降低活化能,增大活化分子百分数,加快反应速率,选④。所以选D。 本题难度:一般 3、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是 |
参考答案:A
本题解析:温度越高,反应越快,到达平衡的时间就越少,因此t2>t1;同理压强越大,反应越快,到达平衡的时间就越少,因此p1>p2;A、反应是一个体积减小的、放热的可逆反应,因此升高温度平衡向逆反应方向移动,降低水蒸气的含量;而增大压强平衡向正反应方向移动,增大水蒸气的含量,A正确;B、反应是一个体积不变的、吸热的可逆反应,压强对水蒸气的含量不影响;升高温度平衡向正反应方向移动,增大水蒸气的含量,因此均不符合,B错误;C、反应是一个体积增大的、吸热的可逆反应,升高温度平衡向正反应方向移动,增大水蒸气的含量,不符合图象,C错误;D、反应是一个体积增大的、放热的可逆反应,压强不符合,D错误.答案选A。
考点:考查化学平衡的影响因素及图表。
本题难度:一般
4、填空题 (1)在体积为10升的密闭容器中,500℃、有催化剂存在的条件下,某反应过程中各物质物质的量
n(mol)随时间t(min)的变化曲线如下图。根据图示回答下列问题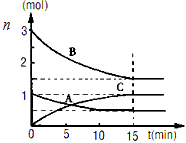
①在0~15min内的平均反应速率:v(B)=______mol/(L·min)
②该反应过程的化学方程式为:_______________________________________。
(2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。若该反应的正反应速率与时间的关系如图所示。
2C(g)+Q(Q>0)。若该反应的正反应速率与时间的关系如图所示。
在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是:___________ (用文字表达);
②t4时改变的条件可能是___________(用编号表示,多选扣分)。
A.增大压强 B.减小压强 C.使用催化剂 D.升高温度 E.增大A的浓度
参考答案:(1)①0.01;②3B+A 2C
2C
(2)①降温;②AC
本题解析:
本题难度:一般
5、选择题 某生成物B的浓度为0.5mol·L-1,经5s后浓度为2.0 mol·l-1,则这5s内B的化学反应速率为(? )
A.0.10 mol·(L·s)-1
B.0.20 mol·(L·s)-1
C.0.30 mol·(L·s)-1
D.0.40 mol·(L·s)-1
参考答案:C
本题解析:反应速率通常用单位时间内浓度的变化量来表示,据此可知,这5s内B的化学反应速率为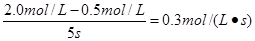 ,答案选C。
,答案选C。
点评:该题是高考中的常见考点,属于基础性试题的考查。主要是考查学生对反应速率以及反应速率计算的熟悉了解程度,意在培养学生分析、归纳、总结问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《大气污染与.. | |