| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《原电池原理》高频考点预测(2017年最新版)(十)
参考答案:C 本题解析:①锌极是负极,发生溶解,铜极是正极,产生气泡,故错;③负极失去电子,发生氧化反应,故错;④阳离子移向正极,即铜极,故错。故选C。 本题难度:简单 3、选择题 浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2? |
参考答案:C
本题解析:A、Li为碱金属,能与H2O反应,所以电解液不能是水溶液,错误;B、电池放电时,负极发生失去电子的反应,为氧化反应,错误;C、根据总反应方程式可得充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2,正确;D、放电时电解液导电原理是阴阳离子的定向移动,不发生电子的移动,错误。
本题难度:一般
4、选择题 下图是课外活动小组设计的用化学电源使LED灯发光的装置。 下列说法错误的是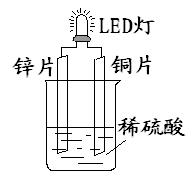
A.铜片表面有气泡生成
B.装置中存在“化学能→ 电能→ 光能”的转换
C.如果将硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
参考答案:C
本题解析:C、柠檬汁呈酸性,会和锌片发生氧化还原反应,导线有电子流动,故错。故选C。
点评:本题考查原电池,明确原电池的原理及由给出的用品构成原电池即可解答,题目难度不大。
本题难度:简单
5、选择题 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是
[? ]
A.电池工作时,锌失去电子
B.电池工作时,电子由正极通过外电路流向负极
C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《氧化还原、.. | |