微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,其电极反应为:X极:CH4+10OH――8e-=CO32-+7H2O,Y极:4H2O+2O2+8e-=8OH-,关于此燃料电池的有关说法错误的是
A.X为负极、Y为正极
B.工作一段时间后,KOH的物质的量不变
C.在标况下通过5.6 LO2完全反应则有1.0 mol电子发生转移
D.该电池工作时甲烷一极附近溶液pH升高
参考答案:D
本题解析:
本题难度:一般
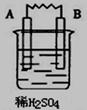
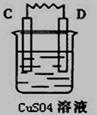
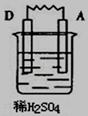
2、实验题 (8分)由A、B、C、D四种金属按下表中装置进行实验,已知用C与B相连作电极放入硫酸铜溶液中B溶解。根据实验现象填表:
装置
| 
| 
| 
|
现象
| 金属A断溶解
| C的质量增加
| A上有气体产生
|
正极反应式
| ?
| ?
| ?
|
四种金属活动性有强到弱的顺序:
|
?
参考答案:
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以根据装置1可知A的金属性强于B的,其中正极反应式为2H++2e-=H2↑;根据装置2可知D的金属性强于C的,其中正极反应式为Cu2++2e-=Cu;根据装置3可知D的金属性强于A的,其中正极反应式为2H++2e-=H2↑。又因为C与B相连作电极放入硫酸铜溶液中B溶解,所以四种金属的活泼性是D>A>B>C。
本题难度:一般
3、选择题 下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1?mol电子转移,则生成1?molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
参考答案:A.电解池阴极上得电子发生还原反应,故A错误;
B.用惰性电极电解Na2SO4溶液,阴极上析出氢气,阳极上析出氧气,氢离子得2mol电子生成1mol氢气,4mol氢氧根离子失去4mol电子生成1mol氧气,所以阴阳两极产物的物质的量之比为2:1,故B错误;
C.设生成x氢氧化钠,
2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑转移电子
? 2mol?2mol
?x? ? 1mol
x=2mol×1mol2mol=1mol,
所以生成1mol氢氧化钠,故C正确;
D.镀层破损后,镀锡铁板中铁作负极,镀锌铁板中铁作正极,所以镀锌铁板比镀锡铁板更耐腐蚀,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
A.牺牲阴极的阳极保护法是应用电解原理防止金属的腐蚀
B.CO的标准燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+566.0 kJ·mol-1
C.一个反应能否自发进行取决于该反应是放热还是吸热
D.用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH
参考答案:B
本题解析:A中应该是原电池原理,不正确。C不正确,应取决于△G=△H-T·△S是否小于0,C正确。D中试纸不能润湿,不正确。答案选B。
本题难度:简单
5、计算题 利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
(1)该原电池的正极反应式为:______________________
(2)计算原稀硫酸的物质的量浓度。
(3)若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢?__________(填“能”或“不能”) 若能组成原电池,此原电池的负极反应式是_____________________
参考答案:(1)2H++2e-==H2↑
(2)0.75mol/L
(3)能;Zn-2e-=Zn2+
本题解析:
本题难度:一般