微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据报道,某星球大气中含有一种称为硫化羰(COS)的化合物,其分子结构与二氧化碳类似,能在氧气里燃烧。下列关于硫化羰的说法正确的是
A.二氧化碳是非极性分子而硫化羰是极性分子
B.二氧化碳与硫化羰均无还原性
C.固体硫化羰是原子晶体
D.硫化羰是一种酸性氧化物
参考答案:A
本题解析:略
本题难度:简单
2、填空题 已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大。A与另外四种元素既不在同一周期,也不在同一主族。J和D同主族,E和G同周期;元素G是周期表中的第7列元素,E的最外层电子数与最内层电子数相同,E跟J可形成离子化合物,其晶胞结构(其中J原子在晶胞内部)如图。
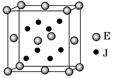
请回答下列问题:
(1)D元素-1价离子的电子排布式为?;G元素原子的价电子排布式为?。
(2)元素J与氮元素可以形成化合物NJ3,其中N—J键的化学键类型为?,根据价层电子对互斥理论可以判断NJ3的空间构型为?,NJ3分子中N原子的杂化方式为?杂化。
(3)A、J形成的化合物AJ的相对分子质量比A、D形成的化合物AD的相对分子质量小,但AJ的沸点比AD高,其原因是?。
(4)从晶胞图可以得出:E与J形成的离子化合物的化学式为?。
(5)含有E元素的化合物焰色反应为?色,焰色反应的原理是?。
参考答案:(1)1s22s22p63s23p6(2分) ? 3d54s2(2分)
(2)共价键(或极性共价键)(1分) ?三角锥形(1分) ? sp3(2分)
(3)前者分子间存在氢键(2分)
(4)CaF2(2分)
(5)砖红(1分)
激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量(2分)
本题解析: A与另外四种元素既不在同一周期,也不在同一主族。判断A是H元素;元素G是周期表中的第7列元素,则G是周期表中第四周期第七副族元素Mn元素;E和G同周期,E的最外层电子数与最内层电子数相同,最内层电子数是2,所以E是Ca元素;E跟J可形成离子化合物,通过计算其晶胞结构中E与J的离子个数比是1:2,则J是-1价非金属;J和D同主族,所以J和D应为F、Cl元素。
(1)Cl元素-1价离子的电子排布式为1s22s22p63s23p6,G是25号Mn元素,其价电子排布式为3d54s2
(2)NF3分子中含有共价键,根据价层电子对互斥理论,中心原子的价层电子对数是4有1对孤对电子,所以空间构型是三角锥型,sp3杂化;
(3)HF分子间存在氢键,使沸点升高;
(4)从晶胞图可以得出:E与J形成的离子个数比为1:2,所以化学式为CaF2
(5)Ca元素的焰色反应是砖红色,焰色反应是因为激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量
本题难度:一般
3、简答题 现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构
X
最外层电子数是次外层电子数的3倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
第三周期元素的简单离子中半径最小
|
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是______,元素Z的离子结构示意图为______.
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论______.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为______.
(4)元素X与元素Y相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______.
a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b.?X的单质比Y的单质更容易与H2?化合
c.X与Y形成的化合物中Y元素呈正价态.
参考答案:短周期元素中,最外层电子数是次外层电子数的3倍,即第一层电子数为2,第二层电子数为6,则X为氧元素;常温下单质为双原子分子,其氢化物水溶液呈碱性,即氢化物为氨气,则Y为氮元素;第三周期元素的简单离子中半径最小,阴离子的半径大于阳离子的半径,金属离子中原子序数越大的半径最小,则Z为铝元素;
(1)因氧元素的单质臭氧具有强氧化性,则可在生活中常用作饮水机的消毒剂,铝离子的质子数为13,核外电子数为10,其结构示意图为
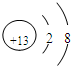
,
故答案为:O3;
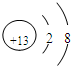
;
(2)因铵根离子能与碱反应生成氨气,且氨气能使湿润的红色石蕊试纸变蓝,故答案为:取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子;
(3)Z元素最高价氧化物对应的水化物,Al(OH)3与NaOH的反应为Al(OH)3+NaOH=NaAlO2+2H2O,离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;?
(4)因N、O元素处于同周期,同周期随原子序数的增大,非金属在增强,故O元素的非金属强,a中的氧化还原反应可判断氧气的氧化性大于氮气的氧化性,则氧的非金属性大于氮元素的非金属性,b中与氢气的化合的难易程度可知氧的非金属性强,c中氧比氮元素容易得到电子,则氧的非金属强,故答案为:O;a,b,c.
本题解析:
本题难度:一般
4、选择题 下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
[? ]
A.6 和8
B.11 和13
C.11 和16
D.12 和17
参考答案:D
本题解析:
本题难度:简单
5、填空题 【物质结构与性质】
天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。
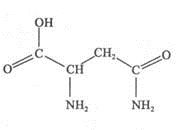
(1)天冬酰胺所含元素中?(填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有?种。
(2)H2S和H2Se的参数对比见下表。
化学式
| ?键长/nm
| 键角
| 沸点/℃
|
H2S
| 1.34
| 92.3o
| 一60.75
|
H2Se
| 1.47
| 91.0o
| 一41.50
|
①H2Se的晶体类型为?,含有的共价键类型为?。
②H2S的键角大于H2Se的原因可能为?。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号
| I5/kJ·mol-1
| I6/kJ·mol-1
| I7/kJ·mol-1
| I8/kJ·mol-1
|
A
| 6990
| 9220
| 11500
| 18770
|
B
| 6702
| 8745
| 15455
| 17820
|
C
| 5257
| 6641
| 12125
| 13860
|
A是?(填元素符号),B的价电子排布式为?。
参考答案:(1)氮? 2
(2)①分子晶体?极性键
②由于S的电负性强于Se,形成的共用电子对斥力大,键角大
(3)Mn? 3d54s1
本题解析:(1)根据天冬酰胺结构可判断所含元素为C、H、N、O,价电子排布式分别为:2s22p2、1s1、2s22p3、2s22p4,未成对电子分别为:2、1、3、2,故氮元素未成对电子最多;从结构中看碳原子形成的化学键的类型有单键和双键,碳原子中碳以sp3和sp2杂化。
(2)①从表中数据看,H2Se沸点很低,故为分子晶体;H2Se中H和Se是不同的非金属原子,故形成的为极性共价键。
②从数据看,由于H-S键键长比H-Se键长短,两氢原子距离更近,斥力更强,因而H2S的键角更大(或由于S的电负性比Se大,使共用电子对间的排斥力变大,因而H2S的键角更大。
(3)钼和铬在同一副族,性质存在相似性和递变性,故电离能也存在相似性,B、C电离能变化相似,且铬的金属性小于钼,故铬的电离能比钼的相应要大,故B为铬,C为钼,A代表锰元素,元素符号为Mn,铬的价电子排布为3d54s1。
本题难度:一般