微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是原子半径最小的元素
|
B元素原子的核外p电子数比s电子数少1
|
C原子的第一至第四电离能分别是:
I1=738kJ/mol? I2 =" 1451" kJ/mol? I3 = 7733kJ/mol? I4 = 10540kJ/mol
|
D原子核外所有p轨道全满或半满
|
E元素的主族序数与周期数的差为4
|
F是前四周期中电负性最小的元素
|
G在周期表的第七列
|
?
(1)已知BA5为离子化合物,写出其电子式?
(2)B基态原子中能量最高的电子,其电子云在空间有?个方向,原子轨道呈?形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,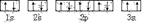
该同学所画的电子排布图违背了?
(4)G位于?族?区,价电子排布式为??
(5)DE3 中心原子的杂化方式为?,用价层电子对互斥理论推测其空间构型为?
(6)检验F元素的方法是??,请用原子结构的知识解释产生此现象的原因是?
?
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为??cm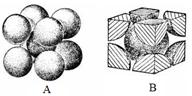
2、选择题 下列各项中表达正确的是
[? ]
A.F- 的结构示意图﹕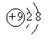
B.CO2的分子模型示意图:
C.NaCl的电子式:
D.N2的结构式: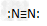
3、选择题 肼(N2H4)分子中所示原子均达到稀有气体原子的稳定结构,它的沸点高达l13℃,燃烧热为642kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃电池。已知肼的球棍模型如图所示,下列有关说法正确的是
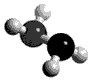
[? ]
A.肼是由极性键和非极性键构成的非极性分子
B.肼沸点高达l13℃,可推测肼分子间可形成氢键
C.肼燃烧的热化学方程式为:N2H4(g)+O2(g) = N2(g) +2H2O(g);△H=-642 kJ·mol-1
D.肼-氧气燃料电池,负极的电极反应为:O2+2H2O+4e-=4OH-
4、填空题 用电子式表示下列化合物的形成过程:
(1)硫化钠:______;
(2)二氧化碳:______.
5、选择题 下列说法正确的是
[? ]
A.含有金属元素的化合物一定是离子化合物
B.IA族和ⅦA族原子化合时,一定生成离子键
C.完全由非金属元素形成的化合物可能是离子化合物
D.活泼金属与非金属化合时,一定能形成离子键