微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z、W是原子序数依次递增的4种短周期元素。其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是
A.X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等
B.X与Z为同主族元素,它们的单质与W单质反应均失去电子
C.Y、Z、W 3种元素组成的某种化合物可用于消毒
D.Y与Z的单质在常温下反应生成Z2Y2
参考答案:C
本题解析:试题分析:X是周期表中原子半径最小的元素,则X是H;Y原子最外层电子数是次外层电子数的3倍,因此Y是O;Z原子的L层电子数比K层与M层电子数之和多5个,所以Z是Na;W在同周期元素中非金属性最强,且W的原子序数大于钠的,因此W是氯元素。H、O、Na种元素组成的化合物中氢氧化钠中阴、阳离子为OH?、Na+,所含电子数相等,都是10电子,故A项不正确;氢气和氯气化合生成氯化氢,形成的是共价键,通过共用电子对成键,B不正确;次氯酸钠可用于消毒,C正确;钠和氧气在常温下生成Na2O,D不正确。
考点:本题考查元素的推断、元素周期表的结构和元素周期律的应用。
本题难度:困难
2、推断题 A、B、C、D、E、F、G七种元素的原子序数依次增大且不超过20。在周期表中A的原子半径最小;D是地壳中含量最大的元素,B、D的原子序数之比为 3:4,A和E、B和F同主族,A、D、E的原子序数之和等于G的原子序数,请回答:
(1)A与D形成的化合物固态时的晶体类型是____________ 。
(2)化合物BD2的结构式为___________,化合物GB2的电子式为_____________。
(3)C和F结合可生成一种超硬物质,有关该物质性质的叙述中不正确的是(填序号)___________。
①有润滑性②易磨损③抗腐蚀④强还原性⑤抗冷热
(4)F单质与NaOH溶液反应的离子方程式______________ 。
(5)将物质的量比为1:1的CO2和H2O组成的混合气体,通入到a mol的E2D2(固体过量)中,反应后的固体混合物加入到500 mL 1 mol·L-1盐酸中,产生无色混合气体的体积在标准状况下为bL,反应后溶液呈中性,则a=____, b=____。
参考答案:(I)分子晶体;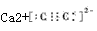
(2)O=C=O; Ca2+
(3)②④
(4)Si +2OH- + H2O==SiO32- +2H2↑
(5)0.25;2.8
本题解析:
本题难度:一般
3、选择题 下列各组性质的比较中正确的是( )
A.酸性:HClO4<HBrO4<HIO4
B.碱性强弱:KOH>NaOH>LiOH
C.稳定性:HCl>PH3>H2S
D.氧化性:I2>Br2>Cl2
参考答案:A.同一主族中,元素的非金属性随着原子序数的增大而减小,所以非金属性Cl>Br>I,非金属的非金属性越强,其最高价含氧酸的酸性越强,所以酸性:HClO4>HBrO4>HIO4,故A错误;
B.同一主族中,元素的金属性随着原子序数的增大而增大,所以金属性K>Na>Li,金属的金属性越强,其对应碱的碱性越强,所以碱性强弱:KOH>NaOH>LiOH,故B正确;
C.同一周期中,元素非金属性随着原子序数的增大而增大,所以非金属性Cl>S>P,非金属的非金属性越强,其氢化物的稳定性越强,所以稳定性HCl>H2S>PH3,故C错误;
D.同一主族中,元素的非金属性随着原子序数的增大而减小,所以非金属性Cl>Br>I,非金属的非金属性越强,其单质的氧化性越强,所以氧化性I2<Br2<Cl2,故D错误;
故选B.
本题解析:
本题难度:简单
4、简答题 某教师在上《元素周期表》复习课时,组织了一个“介绍自己”的活动:

我们班级中共有44位同学,分为8个小组,按从左到右分别为IA、IIA…VIIA、0族,从上到下分别为第一、二…六周期.座位上的每一位同学对应一种元素,请在下列问题中符合要求的同学向大家介绍自己.
请你一起思考并回答下列问题:
(1)第三周期IVA族的元素对应座位号是______,原子结构示意图为______.
(2)座位号为22的元素在元素周期表中的位置是______.
(3)比较座位号为18、19对应的元素的非金属性强弱,请用离子方程式表示______.
(4)课堂中有学生提出,这样的安排会导致他们没有对应的元素,则学生对应的座位号是______.
参考答案:(1)最右边为0族,第三周期IVA族的元素为Si,则其座位号为16,其质子数为14,其原子结构示意图为

,
故答案为:16;

;
(2)座位号为22的元素为Ca,位于第四周期第IIA族,故答案为:第四周期第IIA族;
(3)座位号为18、19对应的元素分别为S、Cl,能说明氧化性强弱的离子反应为Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-,
故答案为:Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-;
(4)因1为H,4为He,则2,3没有相应的座位号,故答案为:2,3.
本题解析:
本题难度:一般
5、选择题 按C、N、O、F的顺序,其性质表现为递减的是( )
A.最外层电子数
B.原子半径
C.非金属性
D.单质的氧化性
参考答案:B
本题解析:
本题难度:简单