微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.将100g?10%的盐酸加热蒸发,得到50克溶液,其浓度为20%
B.把100?mL?3?mol/L的硫酸跟100?mL H2O混合,所得溶液物质的量浓度大于1.5?mol/L
C.把200?mL?3?mol/L的BaCl2溶液跟100?mL 3?mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3?mol/L
D.已知某温度KNO3的溶解度是31.6?g/100g水,在该温度下将20g?KNO3溶解于50?g水中,所得溶液的质量分数是28.6%
参考答案:A.加热HCl挥发,盐酸的浓度降低,故A错误;
B.微粒之间具有间隙,混合后所得硫酸的体积小于200mL,故所得溶液物质的量浓度大于1.5?mol/L,故B正确;
C.3mol?L-1的BaCl2溶液中氯离子浓度为6mol?L-1,3mol?L-1的KCl溶液中氯离子浓度为L3mol?L-1,混合后氯离子浓度,介于之间3mol?L-1~6mol?L-1,故C错误;
D.某温度KNO3的KNO3的溶解度是31.6?g/100g水,则该温度下50g水中溶解KNO3的质量为31.6g×50g100g=15.8g,为饱和溶液,所得溶液的质量分数是15.8g15.8g+50g×100%=24.01%,故D错误;
故选B.
本题解析:
本题难度:简单
2、填空题 将2.3克钠投入到水(滴有酚酞)中,反应结束后,溶液是0.1升。则:
(1)反应过程中,可以发现钠浮在水面,说明钠的密度 (填“大于”“小于”“等
于”)水的密度,溶液最后显 色。
(2)化学反应方程式是 。
(3)求最后溶液的物质的量浓度是多少?(写出解题过程)
参考答案:(1)小于(1分) 红色(1分)
(2)2Na+2H2O=2NaOH+H2↑
(3)1mol / L
本题解析:根据原子守恒,氢氧化钠的物质的量和钠的物质的量相等,结合公式得
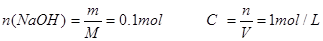
考点:考查钠的性质、物质的量的有关计算。
本题难度:一般
3、选择题 已知14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将(?)
A.大于40%
B.等于40%
C.小于40%
D.无法确定
参考答案:A
本题解析:由于硫酸的密度随浓度的增大而增大,所以根据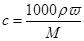 可知,7 mol/L的H2SO4溶液的溶质质量分数将大于40%,选项A正确,答案选A。
可知,7 mol/L的H2SO4溶液的溶质质量分数将大于40%,选项A正确,答案选A。
本题难度:一般
4、选择题 在100克浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加水的体积为(提示:硫酸溶液浓度越大,其密度越大;水的密度为1.0 g/cm3)
A.大于100mL
B.等于100mL
C.小于100mL
D.等于100/ρmL