微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中由于水解使溶液的PH小于7的是(? )
A.NaHCO3
B.NH4Cl
C.Na2SO4
D.NaHSO4
参考答案:B
本题解析:结合盐类水解的有关规律,由于水解使溶液的PH小于7的应是强酸弱碱盐的水解。
本题难度:简单
2、选择题 25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+)
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下列有关物质浓度关系的描述,正确的是? ( )。
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(CO32—)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)
参考答案:AD
本题解析:25 ℃时,NaB溶液中根据电荷守恒可得:c(Na+)+c(H+)=c(B-)+c(OH-),则c(Na+)-c(B-)=c(OH-)-c(H+),根据NaB溶液的pH=8,则pOH=6,故c(Na+)-c(B-)=c(OH-)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1=9.9×10-7mol·L-1,A正确;向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液,首先发生的反应是2NH4HSO4+2NaOH===(NH4)2SO4+Na2SO4+2H2O,此时c(SO42—)=c(NH4+),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(SO42—)>c(NH4+)>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c(CO32—)+c(HCO3—)=c(H+)+c(Na+),物料守恒式为c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3),所以c(OH-)+c(CO32—)=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH>HCO3—,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3),D正确。
本题难度:一般
4、填空题 (14分)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)该溶液中存在的电离平衡是______________________________________和________________________________,水解反应为_________________________。(用方程式表示)
(2)溶液中c( Na+ )=?、c( Cl—)=?
(3)c ( NH4+) ?0.01mol/L(填 > 、 < 或=)
(4)写出溶液中电荷守恒的等式______________________________________?。
参考答案:(1)NH3·H2O  ?NH4++OH-;? H2O
?NH4++OH-;? H2O  ?H++OH-;NH4++H2O
?H++OH-;NH4++H2O  ?NH3·H2O+H+;(2)0.002mol·L-1;0.01 mol·L-1?(3) <
?NH3·H2O+H+;(2)0.002mol·L-1;0.01 mol·L-1?(3) <
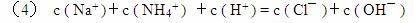
本题解析:略
本题难度:一般
5、选择题 物质的浓度相同的三种盐,NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ 酸性由强到弱的顺序是(?)
A.HX>HZ>HY
B.HZ>HY>HX
C.HX>HY>HZ
D.HY>HZ>HX
参考答案:C
本题解析:酸越弱,相应的钠盐越容易水解,溶液的减小就越强。物质的浓度相同的三种盐,NaX、NaY、NaZ的溶液,其pH依次为8、9、10,所以HX、HY、HZ 酸性由强到弱的顺序是HX>HY>HZ,答案选C。
本题难度:一般