微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2010年3月30日,我国研究人员发表报告认为,全球将有1.4亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡24小时后,其含砷量才能达到食用安全标准。下列对砷(As)的有关判断正确的是 (?)
A.砷原子序数为33,第4周期第5A族
B.砷酸化学式为H2AsO4
C.砷化氢的稳定性比溴化氢的强
D.砷酸的酸性比硫酸的弱
参考答案:D
本题解析:A、第4周期第ⅤA族,错误;B、砷酸化学式为H3AsO4,错误;C、砷的非金属性弱于溴,故砷化氢的稳定性比溴化氢的弱,错误;D、砷比硫的非金属性弱,故砷酸的酸性比硫酸的弱,正确。
本题难度:一般
2、选择题 2011年3月11日,日本福岛核电站因为9.0级大地震引发的海啸受损,产生严重的核泄漏。核泄漏物中含放射性元素碘-131,则有关碘-131(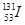 )和碘-127(
)和碘-127(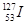 )说法正确的是( )
)说法正确的是( )
A.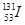 和
和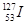 的中子数相同,是同一种核素
的中子数相同,是同一种核素
B.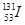 和
和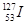 的质子数相同,互为同位素
的质子数相同,互为同位素
C.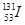 和
和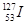 的核外电子排布方式不同
的核外电子排布方式不同
D.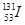 有放射性而
有放射性而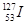 无放射性,说明两者化学性质不同
无放射性,说明两者化学性质不同
参考答案:B
本题解析: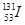 和
和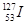 的质子数相同而中子数不同,二者互为同位素,是碘元素的两种核素,A项错误,B项正确,
的质子数相同而中子数不同,二者互为同位素,是碘元素的两种核素,A项错误,B项正确,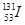 和
和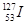 的质子数相同,所以核外电子数相同,核外电子排布方式相同,C项错误;同位素的化学性质相同,D项错误。
的质子数相同,所以核外电子数相同,核外电子排布方式相同,C项错误;同位素的化学性质相同,D项错误。
本题难度:简单
3、填空题 (10分)北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。请回答下列问题:
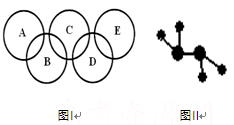
(1)火焰利用了部分金属的______反应,该反应属于______(填“物理”或“化学”)变化。
(2)右图Ⅰ所示的五圆环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素。 A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为?,D的化学式是?。
② A、B、E中均含有的一种元素为??(填元素名称)。
③NH3分子中的N原子有一对孤对电子,能发生反应:NH3 + HCl = NH4Cl。试写出E与足量盐酸发生反应的化学方程式?。
(3)我国科研人员在实验室应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N键。
参考答案:(1)焰色;物理;
(2)① H2O2 HO2-?+ H+;Si3N4;? ② 氢;
HO2-?+ H+;Si3N4;? ② 氢;
③ N2H4 + 2HCl = N2H6Cl2(2分,由于盐酸是足量的,所以若是写成N2H5Cl不给分);
(3)90 (3分);
本题解析:略
本题难度:一般
4、填空题 (12分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
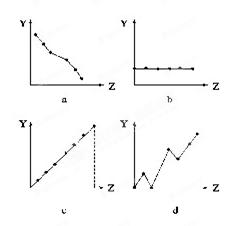
把与下面 元素有关的性质相符的曲线标号填入相应的空格中:
元素有关的性质相符的曲线标号填入相应的空格中:
(1)ⅡA族元素的价电子数____________。
(2)第三周期元素的最高化合价__________。
(3)F-、Na+、Mg2+、Al3+的离子半径________。
(4) 第三周期元素的电负性____________。
参考答案:(12分,每空3分) (1)b? (2)c? (3)a? (4)d
本题解析:略
本题难度:一般
5、填空题 (19分)下表是元素周期表的一部分,回答下列有关问题:(填写元素符号或化学式)
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
|
3
| ③
| ④
| ⑤
| ⑥
| ?
| ⑦
| ⑧
| ?
|
4[]
| ⑨
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
?(1)写出下列元素符号:
①?,⑥?,⑦?,⑧?。
(2)在这些元素中,最活泼的金属元素是?,最活泼的非金属元素是?。
(3)在这些元素中的最高价氧化物对应的水化物中,酸性最强的是?,碱性最强的是??,呈两性的氢氧化物是?,写出实验室制取①的氢化物的化学方程式??
(4)含有元素③的物质的焰色呈?,⑩的单质的保存方法是??
(5)在③与④中,化学性质较活泼的是??,怎样用化学实验证明?(可用化学方程式说明)?
在⑧与⑩中,化学性质活泼的是?,怎样用化学实验证明?(可用化学方程式说明)
?
参考答案:(1)N? Si? S? Cl?(2)K? F?(3)HClO4? KOH? Al(OH)3
2NH4Cl+Ca(OH)2 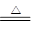 ?CaCl2+2NH3↑+2H2O
?CaCl2+2NH3↑+2H2O
(4)黄色,棕色成剂瓶用水封
(5)Na, 2Na+2H2O ="==" 2Na(OH)2+H2↑(其他合理也给分)Mg+2H2O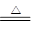 Mg(OH)2+H2↑
Mg(OH)2+H2↑
Cl,? Cl2+2NaBr ="==" Br2+2NaCl(其他合理也给分)
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表做的位置可判断①是N、②是F、③是Na、④是Mg、⑤是Al、⑥是Si、⑦是S、⑧是Cl、⑨是K、⑩是Br。同主族元素自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。同周期元素自左向右原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱。
本题难度:一般