微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学是以一门实验为基础的自然科学,许多实验有丰富的颜色变化,有关实验的颜色变化有错误的是
A.向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色
B.向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色
C.向Fe(NO3) 2溶液中滴加稀硫酸,能使溶液变为棕黄色
2溶液中滴加稀硫酸,能使溶液变为棕黄色
D.将Fe(OH)3胶体装在U形管中做电泳实验时,负(阴)极一端颜色变浅
参考答案:D
本题解析:略
本题难度:一般
2、填空题 在FeSO4溶液中加入NaOH溶液的反应现象是:______,方程式有:______,______.
参考答案:在FeSO4溶液中加入NaOH溶液,先生成白色絮状沉淀,反应化学方程式为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,氢氧化亚铁不稳定,很快被氧化成 灰绿色,最终被氧化成红褐色的氢氧化铁沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
本题解析:
本题难度:一般
3、选择题 将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下气体0.224 L.则下列判断中正确的是(?)
A.无法计算原混合物的质量a
B.原混合物中n(Fe)∶n(Fe2O3)=2∶1
C.向溶液中滴入KSCN溶液,显红色
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
参考答案:B
本题解析:略
本题难度:简单
4、选择题 工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补充
水,也无多余的水分,所用硫酸溶液溶质的质量分数应为
A.45.8%
B.57.6%
C.72.3%
D.无法确定
参考答案:B
本题解析:本题考查计算能力,试题难度中等;根据题意,制 备过程中既不补充水,也无多余的水分,故CuSO4·5H2O中的水来自反应生成的水和硫酸溶液中的水,1molCuSO4·5H2O中含有5mol结晶水,其中有1mol来自CuO和H2SO4反应,故硫酸溶液中的水为4mol,所以硫酸溶液的质量分数为:×100%=57.6%
本题难度:一般
5、简答题 某同学采用如图所示装置进行Fe粉与水蒸气的反应.
(1)写出Fe粉与水蒸气反应的化学方程式______.
(2)该同学向反应后的固体中加入过量的稀HCl,并将溶液分装在两支试管中.
①向第一支试管中滴加KSCN溶液,溶液呈红色,该溶液中存在的阳离子有______.
②向第二支试管中加入适量铁粉.该过程中发生化合反应的离子方程式是______.
再向所得溶液中滴加NaOH溶液并放置一段时间,该步反应中的实验现象是______.发生的氧化还原反应的化学方程式是______.
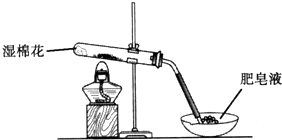
参考答案:(1)该反应的化学方程式是:3Fe+4H2O(g) 高温.Fe3O4+4H2;
故答案是:3Fe+4H2O(g) 高温.Fe3O4+4H2;
(2)①滴加KSCN溶液,溶液呈红色,证明有Fe3+,反应后的固体中一定含有剩余的铁,和盐酸反应生成氯化亚铁,溶液中含有氢离子;
故答案是:Fe3+、Fe2+、H+;
②加入适量铁粉,铁和Fe3+反应,反应的离子方程式是:2Fe3++Fe═3 Fe2+;加入氢氧化钠溶液后,现象是:产生白色沉淀,迅变成灰绿色,最终速变成红褐色;反应的化学方程式为:4Fe(OH)2+O2+2 H2O═4 Fe(OH)3 ;
故答案是:2Fe3++Fe═3 Fe2+; 产生白色沉淀,迅变成灰绿色,最终速变成红褐; 4Fe(OH)2+O2+2 H2O═4 Fe(OH)3 .
本题解析:
本题难度:简单