微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)某学生设计了一个制取氢氧化亚铁的最佳实验方案,实验装置见图,请分析实验过程:
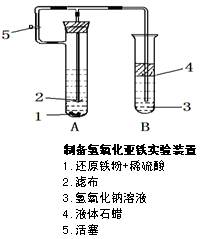
⑴在B试管中加入NaOH溶液后加热煮沸1—2分
钟立即加入2mL液体石蜡,该操作目的是_______________? ________。
⑵在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉过量_________________________。
⑶连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为____________________,原因是_______?。B试管中现象为__?。
参考答案:(1)除去溶解在NaOH溶液中的O2,防止O2再进入
(2)保证溶液中不存在Fe3+
(3)A试管中溶液经导管压入B试管,因为生成的H2产生了压力,产生白色沉淀
本题解析:略
本题难度:一般
2、简答题 .(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
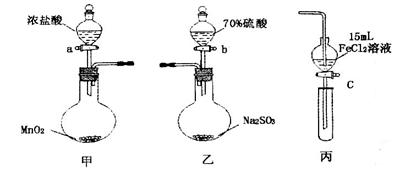
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
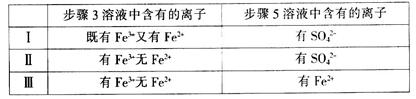
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
参考答案:33.答案(16分)
(1)MnO2 + 4 HCl(浓)= MnCl2 + Cl2↑+ 2H2O (加热)(2分)(不写“加热”、“浓”不得分;不标气体符号扣1分)
(2)70%的H2SO4比98%的H2SO4电离程度大,溶液中H+浓度大,反应速度快 (2分)(只答“70%的H2SO4溶液溶液中H+浓度大”也可得分)
(3)2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO32- + 4H+(2分)
(4)Ⅰ和Ⅲ (4分;各2分)
(5)①FeI2、KSCN、CCl4(3分)
③下层(CCl4层)先由无色变为紫红色(1分);后看到上层溶液由浅绿色(1分)变为红色(1分)。
本题解析: (1)根据甲装置中的物质提示,可以判断该装置是实验室制备氯气的发生装置,所以该装置中发生的反应是MnO2 + 4 HCl(浓)= MnCl2 + Cl2↑+ 2H2O。
(2)装置乙是实验室制备SO2的发生装置,该反应的原理是利用难挥发的酸性强的硫酸制备酸性较弱且易分解的亚硫酸,所以要较快制得较多的亚硫酸(SO2)则需要溶液中含有的氢离子的浓度较大,所以对于不同浓度的硫酸而言,硫酸的浓度小,电离程度越大,所以用70%的硫酸制取SO2,溶液中H+浓度大,反应速率比用98%的硫酸快。
(3)得以证明氧化性Fe3+>SO2 ,则在变黄的氯化亚铁中通入SO2后,SO2又被Fe3+ 氧化,所以反应的离子方程式为2Fe3+ + SO2 + 2H2O =" 2" Fe3+? + SO32- + 4H+ 。
(4)I组同学检验得到的步骤3溶液既含有Fe3+又含有Fe2+ ,说明溶液中的Fe3+ 是氯气氧化而得,且一定不含有过量的氯气,所以步骤5中检测到的SO42-?,也一定是由Fe3+ 氧化SO2所得,因此可以得出结论氧化性:Cl2>Fe3+>SO2 。III组同学检测到的步骤3溶液只有Fe3+不含Fe2+,能说明溶液中的Fe3+ 是氯气氧化而得,而步骤5中检测到的Fe2+,也可以说明溶液中Fe2+ 是SO2还原Fe3+ 而得,所以可以得出氧化性:Cl2>Fe3+>SO2 的结论。II组同学检测到的步骤3溶液只有Fe3+不含Fe2+,与III组同学相似,溶液中都有可能溶解有过量的氯气,因此步骤5中检测到的SO42-?,有可能是溶解在其中的过量氯气氧化SO2所得,所以不能说明氧化性Fe3+>SO2 ,因此选I、III。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则必须要在分液漏斗中加入含有Fe2+ 、I-的试剂,所以可以选用FeI2 盐溶液;证明氧化生成了Fe3+和 I2 则需要加入检验性的试剂KSCN和有机溶剂如CCl4。若观察分层的溶液的上层浅绿色变红,下层显紫红色,则结论正确。
本题难度:一般
3、计算题 (8分)某工厂用FeC13溶液腐蚀镀有铜的绝缘板生产印刷电路。
(1)用离子方程式表示其化学原理?。
某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00 mL。废液,向其中加入0.64 g金属铜,金属铜全部溶解;又取50.00 mL废液,向其中加入足量AgNO3溶液,析出沉淀43.05 g。请回答以下问题:
(2)该厂生产后废液中所含金属阳离子有
(3)该厂原来使用的FeCl3溶液的物质的量浓度为?。(设反应前后溶液的体积无变化);
(4)若向500.00 mL废液中加入足量的稀硝酸,在
标准状况下生成NO气体4.48 L,则原废液中各
金属阳离子的物质的量浓度之比为?。(离
子与比值一一对应)。
参考答案:

本题解析:略
本题难度:一般
4、填空题 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
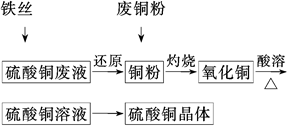
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有______________________________________________
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是___________________
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
参考答案:(1)Fe2O3+6H+=2Fe3++3H2O,
2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑
(2)C或CO 2CuO+C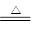 2Cu+CO2↑或CuO+CO
2Cu+CO2↑或CuO+CO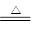 Cu+CO2
Cu+CO2
(3)2Cu+O2+2H2SO4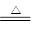 2CuSO4+2H2O
2CuSO4+2H2O
(4)生成等量CuSO4晶体所消耗的H2SO4更多,且会产生污染大气的气体
本题解析:废铁丝中含有铁锈(Fe2O3·xH2O),所以在用稀硫酸处理时可能发生的反应有:Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑;废铜粉在灼烧后得到的产物中含有单质铜,可能是原来杂质中含有C等还原性杂质导致;Cu在不断通入氧气和加热的条件下,可溶解于稀硫酸中,发生反应2Cu+O2+2H2SO4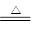 ?2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓)
?2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓)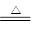 CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。
CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。
本题难度:一般
5、简答题 某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色.

(1)请写出下列物质的化学式:A______、C______.
(2)在①②③④各步反应中属于氧化还原反应的有______(填序号).
(3)请分别写出反应①的化学方程式和反应③的离子方程式:①______、③______.
参考答案:已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2溶液,
(1)依据推断可知A为Fe(OH)3,C为H2O,故答案为:Fe(OH)3;H2O;
(2)反应①是氢氧化铁分解生成氧化铁和水的反应,2Fe(OH)3△.Fe2O3+3H2O,属于分解反应,不是氧化还原反应;
反应②是盐酸和氧化铁发生的复分解反应,Fe2O3+6HCl=2FeCl3+3H2O,不是氧化还原反应;
反应③是氯化铁和铁发生的氧化还原反应,Fe+2FeCl3=3FeCl2,氧化还原反应;
反应④是氢氧化亚铁和氧气水 发生反应生成氢氧化铁的也还原反应,反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,是氧化还原反应;
故答案为:③④;
(3)反应①是氢氧化铁受热分解的反应,化学方程式为2Fe(OH)3△.Fe2O3+3H2O,反应③是铁和氯化铁反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe═3Fe2+,
故答案为:2Fe(OH)3△.Fe2O3+3H2O;2Fe3++Fe═3Fe2+.
本题解析:
本题难度:简单